Przeczytaj
Pierwiastki bloku położone w okresie układu okresowego
Układ okresowy pierwiastków podzielony jest na bloki , , i .
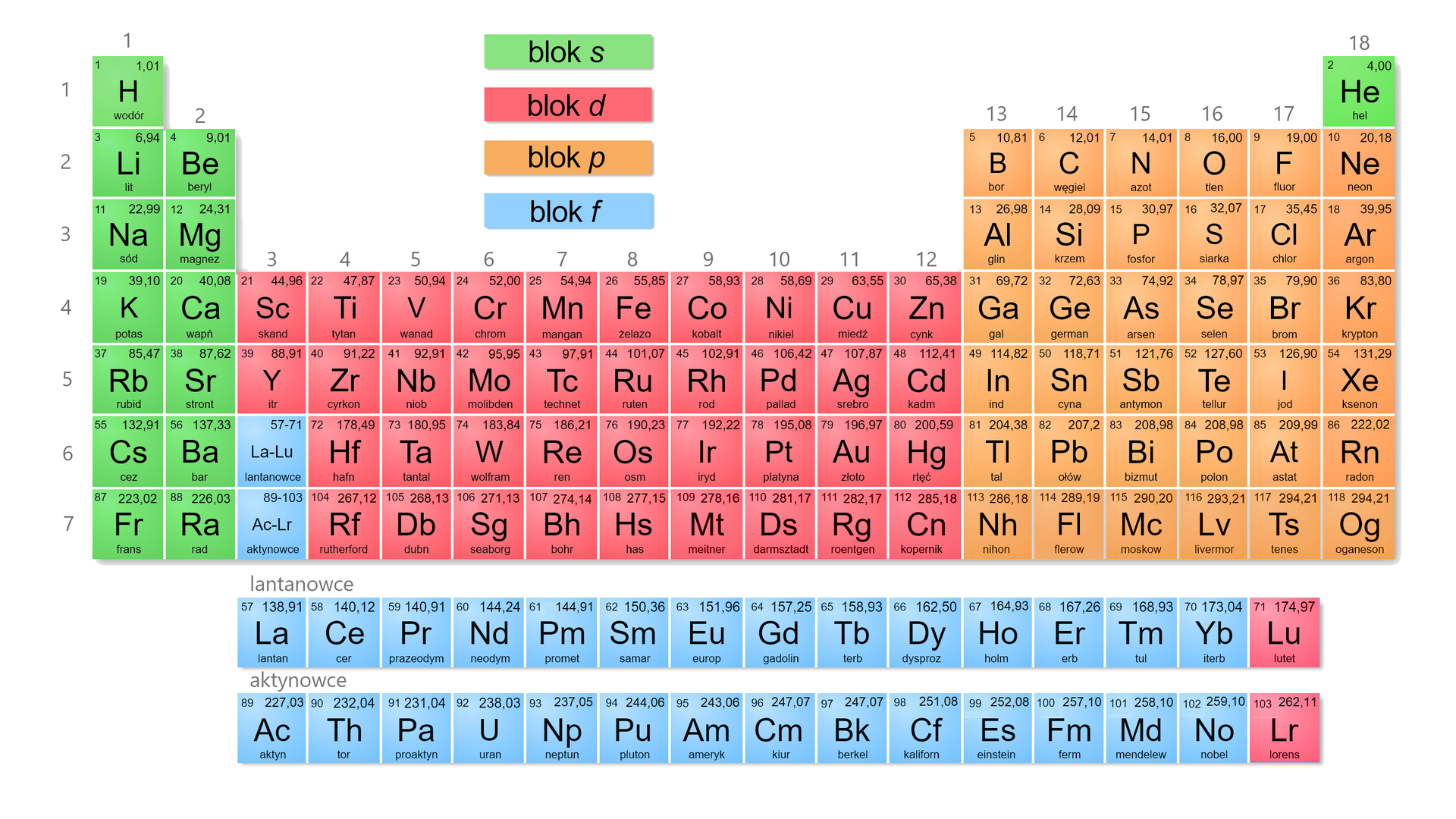
Podział pierwiastków na bloki wynika z obsadzenia przynajmniej jednego elektronu walencyjnegoelektronu walencyjnego na odpowiedniej podpowłoce, na przykład w bloku elektrony walencyjne są obsadzone na podpowłoce . Elektrony walencyjne odgrywają istotną rolę we właściwościach pierwiastków – to one są w głównej mierze odpowiedzialne za tworzenie wiązań.
W okresie bloku układu okresowego znajdują się następujące pierwiastki: skand (, ), tytan (, ), wanad (, ), chrom (, ), mangan (, ), żelazo (, ), kobalt (, ), nikiel (, ), miedź (, ) oraz cynk (, ).

Obsadzenie elektronów walencyjnych w atomach pierwiastków okresu bloku układu okresowego w stanie podstawowymstanie podstawowym można zapisać jako:
gdzie:
Część elektronów z orbitalu wraz z elektronami z orbitalu może brać udział w reakcjach chemicznych, dlatego elektrony z orbitalu są elektronami walencyjnymi. Łatwo również zauważyć, że suma liczby elektronów i jest równa numerowi grupy, a co za tym idzie pokazuje maksymalną wartościowość danego pierwiastka.
Ze względu na zbliżoną energię orbitali i od powyższej reguły rozmieszczenia elektronów walencyjnych, można wyróżnić dwa wyjątki w okresie w bloku . Dotyczą one atomów chromu i miedzi.
Rozważmy to na przykładzie:
Zapisz konfigurację elektronową powłoki walencyjnej atomu skandu w stanie podstawowym. Określ maksymalny stopień utlenienia.
Rozwiązanie:
skand;
;
okres układu okresowego;
grupa układu okresowego.
Korzystając ze wzoru:
gdzie:
Zapisujemy konfigurację elektronową powłoki walencyjnej atomu skandu w stanie podstawowym:
Maksymalny stopień utlenienia skandu jest równy sumie liczby elektronów na orbitalach i (), więc jest równy .
Konfiguracja elektronowa powłoki walencyjnej atomu chromu
W przypadku chromu, różnica energii orbitali i jest zbliżona do energii parowania elektronów. Chrom posiada elektronów walencyjnych, dlatego najkorzystniej, ze względu na liczbę niesparowanych elektronów, będzie rozmieścić je w następujący sposób:

Konfiguracja elektronowa powłoki walencyjnej atomu miedzi
Wraz z położeniem pierwiastka w okresie zmniejsza się energia orbitali , w związku z czym, w przypadku miedzi, orbital ma mniejszą energię niż orbital . Dlatego orbital ten powinien być obsadzony w pierwszej kolejności, aby taka konfiguracja miała najniższą energię. Miedź posiada elektronów walencyjnych. Maksymalne obsadzenie orbitalu wynosi elektronów, dlatego konfiguracja miedzi to: , a nie .
W odróżnieniu od pierwiastków grup głównychgrup głównych, pierwiastki bloku mają rozmieszczone elektrony walencyjne na dwóch podpowłokach i . Całkowite obsadzenie orbitalu jest przyczyną tego, że wszystkie pierwiastki bloku są metalami, a ich najniższy stopień utlenienia to (z wyjątkiem miedzi, gdzie następuje przeskok elektronu z podpowłoki na , tworzący trwałe związki miedzi na stopniu utlenienia).
Konfiguracja elektronowa powłoki walencyjnej w jonach metali
Gdy pierwiastki okresu bloku wchodzą w reakcje chemiczne, to w czasie tworzenia kationów oddają najpierw elektrony rozmieszczone na podpowłoce , a dopiero później elektrony rozmieszczone na podpowłoce .

W jonach metali na i wyższym stopniu utlenienia liczba elektronów rozmieszczonych na orbitalach typu (w stanie podstawowym) jest równa całkowitej liczbie elektronów minus ładunek jonu.
Rozpatrzmy to na przykładzie:
Zapisz konfigurację elektronową elektronów walencyjnych:
A. Żelaza
B. Kationu żelaza na stopniu utlenienia
C. Kationu żelaza na stopniu utlenienia
Rozwiązanie:
A.
B. stopnień utlenienia oznacza, że żelazo utraciło elektrony. Pamiętając, że w pierwszej kolejności odchodzą elektrony z powłoki konfiguracja jonu :
C. stopnień utlenienia oznacza, że żelazo utraciło elektrony. Pamiętając, że w pierwszej kolejności odchodzą elektrony z powłoki konfiguracja jonu :
Za tworzenie wiązań chemicznych przez atomy pierwiastków bloku okresu odpowiedzialne są elektrony walencyjne rozmieszczone na dwóch orbitalach oraz . Liczba elektronów walencyjnych jest równa sumie liczby elektronów na orbitalach i oraz numerowi grupy. W trakcie tworzenia kationów, jako pierwsze oddawane są elektrony zajmujące orbital .
Słownik
elektrony odpowiedzialne za tworzenie wiązań chemicznych
stan układu charakteryzujący się najniższą energią
grupy pierwiastków bloku ( i grupa) oraz bloku (grupy od do )
reguła mówiąca o tym, że w atomie do uzyskania najbardziej korzystnego energetycznie zapełnienia powinno znajdować się jak najwięcej niesparowanych elektronów o spinach skierowanych w tę samą stronę
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2006.
Pajdowski L., Chemia ogólna, Warszawa 2002.
Woodgate S., The University of Auckland 2002. Wykłady dla studentów, online: http://bestchoice.net.nz/html/sa1/main/s148/p3960.htm, dostęp: 02.07.2021.