Przeczytaj
Co charakteryzuje pierwiastki z grupy litowców?
Lit, sód, potas, rubid oraz cez tworzą grupę pierwiastków, charakteryzujących się taką samą konfiguracją elektronów z ostatniej walencyjnej powłoki: . W reakcjach chemicznych chętnie oddają elektron walencyjny, aby uzyskać korzystną energetycznie konfigurację najbliższego helowca, tworząc jednododatni kation . Wszystkie litowce są bardzo aktywnymi chemicznie metalami.
Tabela: Pierwiastki grupy
okres | pierwiastek | liczba atomowa | promień atomowy | promień jonowy |
Indeks dolny Źródło: Bielański A., Podstawy chemii nieorganicznej, Warszawa , s. . Indeks dolny koniecŹródło: Bielański A., Podstawy chemii nieorganicznej, Warszawa , s. .
Jak zmienia się aktywność litowców?
Wraz ze wzrostem masy atomowej, atomy litowców, położone w kolejnych okresach, mają coraz większy promień atomowy. Położony na powłoce walencyjnej elektron jest bardziej oddalony od jądra i przez to słabiej przyciągany – łatwiej tworzy się kation. Dlatego aktywność chemiczna kolejnych litowców jest coraz większa.
Litowce przechowuje się w nafcie, a rubid i cez w ampułkach wypełnionych argonem, ponieważ w powietrzu samorzutnie reagują z tlenem i parą wodną.
Jakie są stopnie utlenienia pierwiastków w wodorkach litowców?
Tworząc związki z litowcami, wodór przyjmuje wyjątkowo stopień utlenienia wynoszący . WodorkiWodorki litowców mają charakter jonowy. Są to wodorki typu soli, które zawierają jon wodorkowy .
Reakcje litowców z wodorem:
Porównanie wielkości kationu wodorowego, atomu wodoru i anionu wodorkowego.
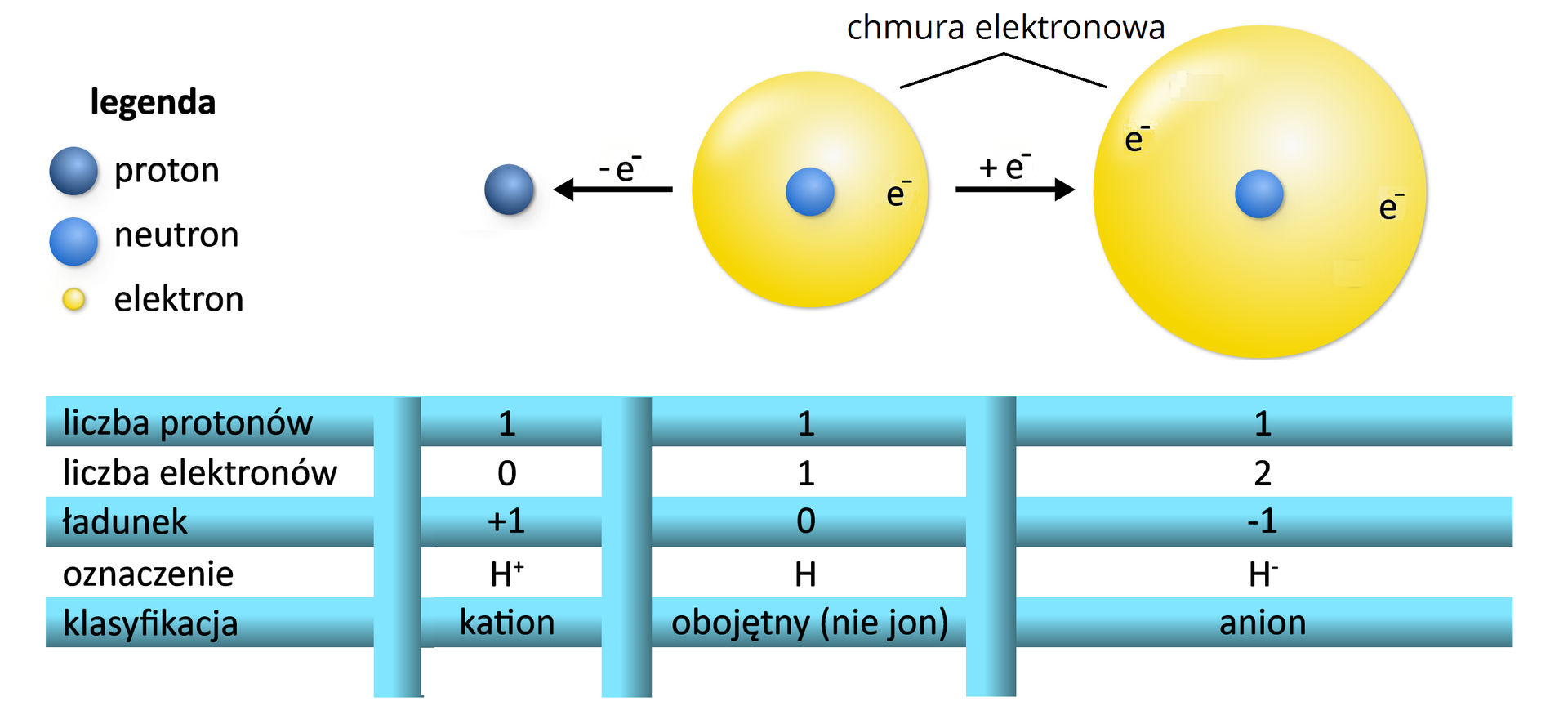
Jon wodorkowy jest stosunkowo duży (promień jonowy wynosi ). Pojedynczy ładunek dodatni nie jest w stanie silnie związać dwóch elektronów w jonie . Oderwanie od niego elektronu wymaga niewielkiej energii, dlatego wodorki typu soli są bardzo silnymi reduktorami. Podobnie jak sód, redukują wodę, np.:
Reakcje litowców z pierwiastkami z grupy , i
Litowce reagują z większością niemetali, z wyjątkiem gazów szlachetnych, dając związki o charakterze soli.
Z węglem litowce tworzą węgliki, które zawierają aniony , np. węglik litu , węglik sodu .
Z azotem reaguje tylko lit, tworząc azotekazotek litu:
Z siarką litowce tworzą siarczki, np.:
siarczek sodu
R1J6GWFFRoM7P  Siarczek soduŹródło: dostępny w internecie: www.commons.wikimedia.org, licencja: CC BY-SA 3.0.
Siarczek soduŹródło: dostępny w internecie: www.commons.wikimedia.org, licencja: CC BY-SA 3.0.siarczek potasu
RNQicr6lZ6nyM  Siarczek potasuŹródło: dostępny w internecie: www.commons.wikimedia.org, licencja: CC BY-SA 4.0.
Siarczek potasuŹródło: dostępny w internecie: www.commons.wikimedia.org, licencja: CC BY-SA 4.0.Z pierwiastkami grupy reagują wszystkie litowce, tworząc halogenki, np. lit tworzy , , , ; sód – , , , .
Wiele z tych soli można pozyskać z minerałów występujących w przyrodzie.
Z chlorem litowce tworzą chlorki, np.:
chlorek litu
chlorek potasu
Związki litowców z niemetalami uzyskuje się z innych związków lub minerałów.
Przykładowo, chlorek litu otrzymywany jest poprzez reakcję węglanu litu lub wodorotlenku litu z kwasem chlorowodorowym.
Reakcje litowców z niemetalami przebiegają bardzo gwałtownie i trudno zobaczyć różnicę w aktywności badanych metali. Taką możliwość daje reakcja z wodą. Produktami są wodorotlenki.
Metaliczny sód roztwarza sie w ciekłym amoniaku i reaguje z nim. W wyniku reakcji powstają kationy sodu oraz tzw. solwatowane elektrony (roztwór ten ma właściwości redukujące).

Powstaje roztwór o intensywnym, niebieskim kolorze.
Słownik
związki tlenu z innymi pierwiastkami
substancje chemiczne, których cząsteczki składają się z atomów dwóch różnych pierwiastków; związkami binarnymi są na przykład tlenki, azotki, chlorki
binarne związki wodoru z innymi pierwiastkami o wzorze ( – atom dowolnego pierwiastka)
związki chemiczne azotu z metalami lub niektórymi niemetalami
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa .
Bielański A., Podstawy chemii nieorganicznej, Warszawa , s. .
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia . Podręcznik, Warszawa , s. .