Przeczytaj
Benzen
Cząsteczka benzenu zbudowana jest z sześciu połączonych ze sobą atomów węgla. Do każdego atomu węgla przyłączony jest atom wodoru.
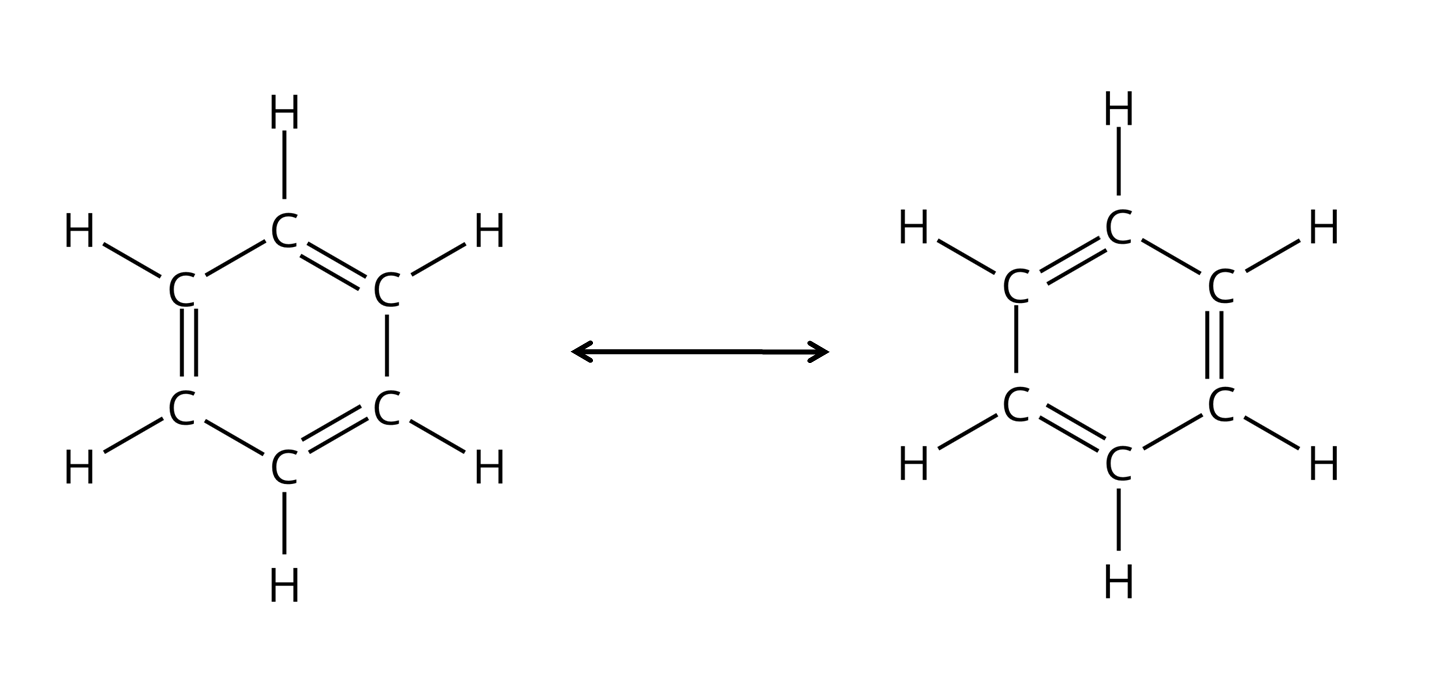
W cząsteczce benzenu występują zdelokalizowane wiązania , które znajdują się między atomami węgla w pierścieniu. Powstają w wyniku rozmycia się chmury elektronowej w okolicy pierścienia, gdzie jest zlokalizowanych sześć elektronów , po jednym od każdego atomu węgla, wchodzącego w skład pierścienia. Delokalizacja tych wiązań jest jedną z charakterystycznych cech związków aromatycznychzwiązków aromatycznych.
Poza wyżej wymienioną właściwością, związki aromatyczne muszą wykazywać również kilka innych cech: są cykliczne, pierścień odznacza się płaską budową (orbitalom walencyjnym atomów węgla budującym pierścień przypisujemy więc hybrydyzację ), a ponadto dla tych związków musi zostać spełniona reguła Hücklareguła Hückla. Według niej związki aromatyczne to takie, które spełniają zasadę zdelokalizowanych elektronów , gdzie jest liczbą naturalną lub zerem. Cząsteczka benzenu posiada sześć elektronów . Oznacza to, że , czyli .
Otrzymywanie benzenu
Otrzymywanie benzenu z węgla i odczynników nieorganicznych
Możliwą metodą otrzymywania benzenu jest ciąg przemian rozpoczynajacy się od reakcji węgla ze związkiem nieorganicznym. Przykładem może być reakcja węgla i wapna palonego () prowadząca do otrzymania acetylenku wapnia (węglika wapnia) i tlenku węgla().
Na kolejnym etapie acetylenek wapnia reaguje z wodą. W reakcji tej wydziela się etyn.
Ostatnim krokiem jest opisana wcześniej trimeryzacja etynu w podwyższonej temperaturze i pod odpowiednim ciśnieniem, z zastosowaniem katalizatora, prowadząca do otrzymania benzenu.
Podsumowanie
Jak widzisz, istnieje wiele metod otrzymywania benzenu. Wykorzystanie jednej z nich zależy od wydajności procesu chemicznego, a także od możliwości laboratorium. Należy jednak pamiętać, że benzen jest substancją rakotwórczą, mutagenną i niebezpieczną. Podczas pracy z tym związkiem należy zachować szczególną ostrożność.
Słownik
cykliczne węglowodory (areny) i niektóre ich pochodne, mające płaskie pierścienie z układem zdelokalizowanych wiązań , dla których spełniona jest reguła Hückla
reguła aromatyczności; charakter aromatyczny (aromatyczność) mogą przejawiać te polieny, posiadające zdelokalizowane wiązania , w których liczba elektronów wynosi , gdzie jest liczbą naturalną lub zerem; reguła ta, wynikająca z zastosowania reguły Hunda do orbitali molekularnych w pierścieniowych układach sprzężonych, została sformułowana w roku przez E. A. Hückla
(gr. katálysis „rozłożenie”) substancja, która zwiększa szybkość reakcji chemicznej, nie naruszając stanu końcowej równowagi i właściwości termodynamicznych układu; katalizator nie zużywa się w trakcie reakcji, jego ilość po ukończeniu reakcji jest zatem taka sama jak przed jej rozpoczęciem
(łac. destillatio „ściekanie kroplami”) proces fizykochemiczny polegający na przeprowadzeniu poprzez ogrzanie substancji ciekłych w stan pary, skropleniu par przez oziębienie i następnie zebraniu skroplonych par (destylatu); metoda rozdziału mieszanin, której podstawą są różnice w wartościach temperatur wrzenia ich składników
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Mastalerz P., Chemia organiczna, Wrocław 2000.
McMurry J., Chemia Organiczna, cz. 3, Warszawa 2007.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, Warszawa 2010, wyd. 5.
Baeyer A., Ueber die Reduction aromatischer Verbindungen mittelst Zinkstaub, „Justus Liebigs Annalen der Chemie” 1866, nr 4, s. 257‑356, online: https://doi.org/10.1002/jlac.18661400306 (dostęp: 01.06.2021).
Fernelius W. C., Watt W. G., Reactions of Solutions of Metals in Liquid Ammonia, „Chem. Rev.” 1937, t. 20, nr 2, s. 195‑258, online: https://doi.org/10.1021/cr60066a003 (dostęp: 01.06.2021).