Wirtualne laboratorium – I
Na podstawie poniższych informacji wykonaj niezbędne obliczenia i przeprowadź eksperyment w laboratorium chemicznym. Wyliczone wartości uzupełnij i sprawdź w umieszczonym zadaniu. Zapoznaj się z problemem badawczym i zweryfikuj własną hipotezę. W formularzu zanotuj swoje obserwacje i wyniki, a następnie zapisz wnioski.
Do kolby okrągłodennej odmierz aniliny , a następnie dodaj kwasu chlorowodorowego . Następnie odważ azotanu sodu i rozpuść w wody. W kolejnym etapie odmierz kwasu fosforowego i dodaj go do uzyskanej w kolbie okrągłodennej mieszaniny. Po zakończeniu reakcji, przeprowadź destylację prostą powstałego roztworu zwracając uwagę na temperaturę, w której destylują poszczególne składniki roztworu.
Ważne!
Na podstawie licznych badań, benzen został uznany za substancję rakotwórczą. W jego przypadku nie ma czegoś takiego, jak bezpieczny poziom narażenia – nawet niewielkie ilości tej substancji mogą wyrządzić szkody naszemu organizmowi.
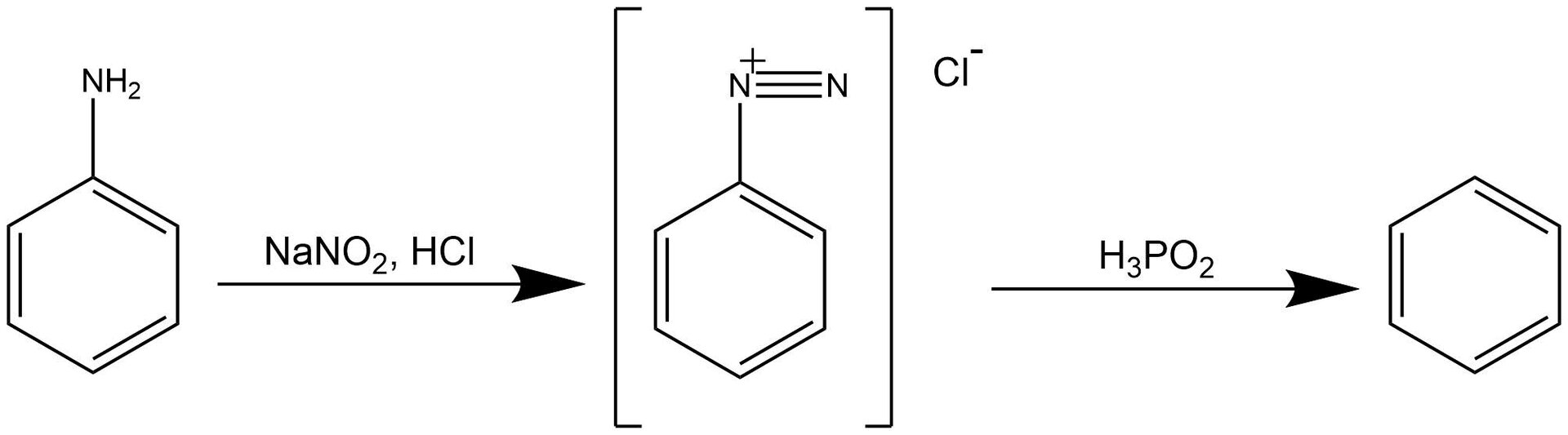
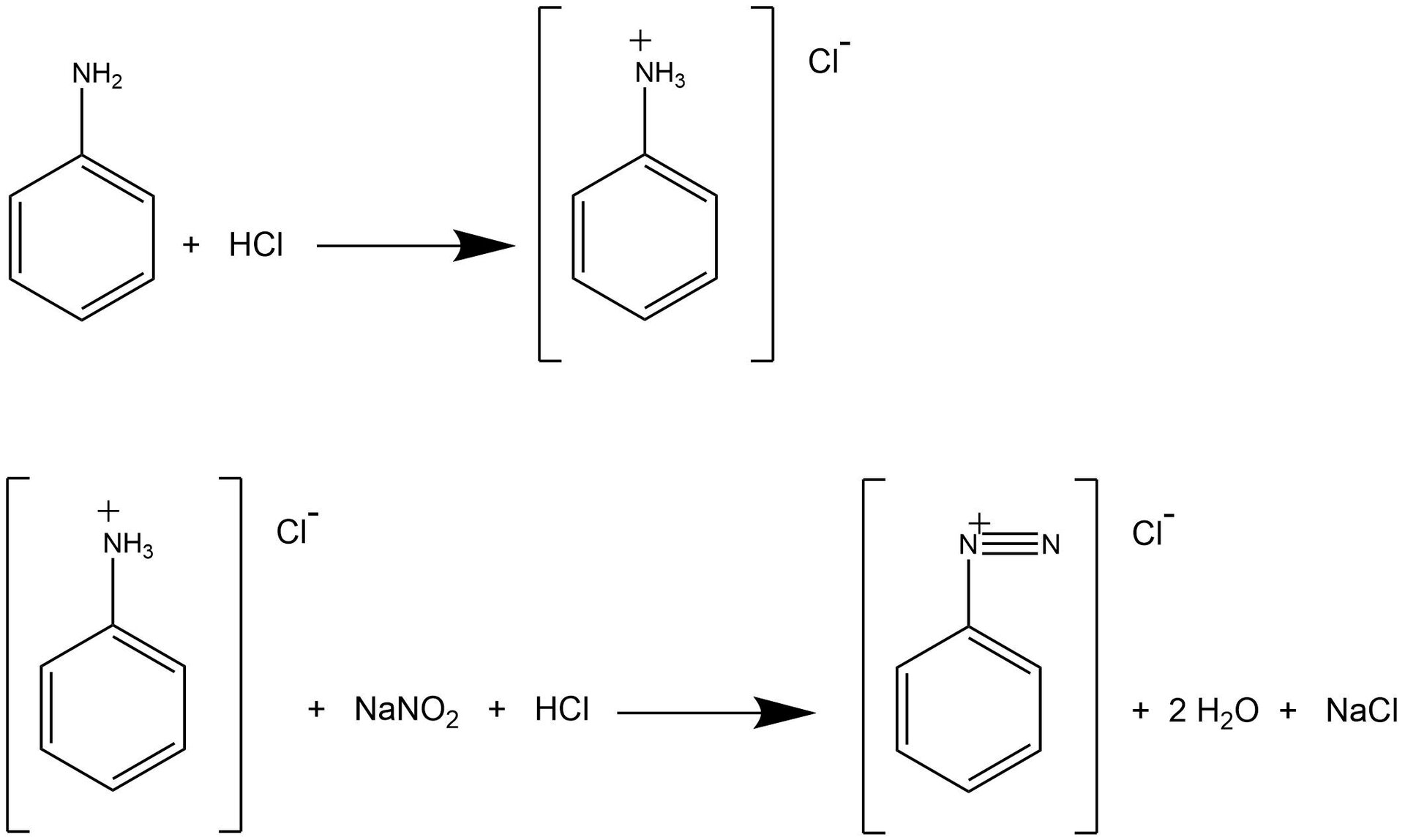
W przedstawionym niżej laboratorium zastosowano metodę otrzymywania benzenu, która składa się z dwóch etapów. W pierwszym etapie zastosowano reakcję diazowania. W wyniku reakcji aminy aromatycznej (anilina) z kwasem azotowym (który został otrzymany w reakcji azotanu sodu z kwasem solnym) otrzymano sól diazoniową. Sole diazoniowe to grupa związków organicznych o wzorze ogólnym . Reakcja ta wymaga zastosowania odpowiednich warunków, aby mogła przebiec prawidłowo. Aromatyczne sole diazoniowe są trwałe w temperaturze od do , dlatego reakcja prowadzona jest w łaźni lodowej. Należy użyć nadmiaru kwasu solnego. Zapewnia on odpowiednie pH reakcji, które jest niezbędne do ustabilizowania soli diazoniowych.
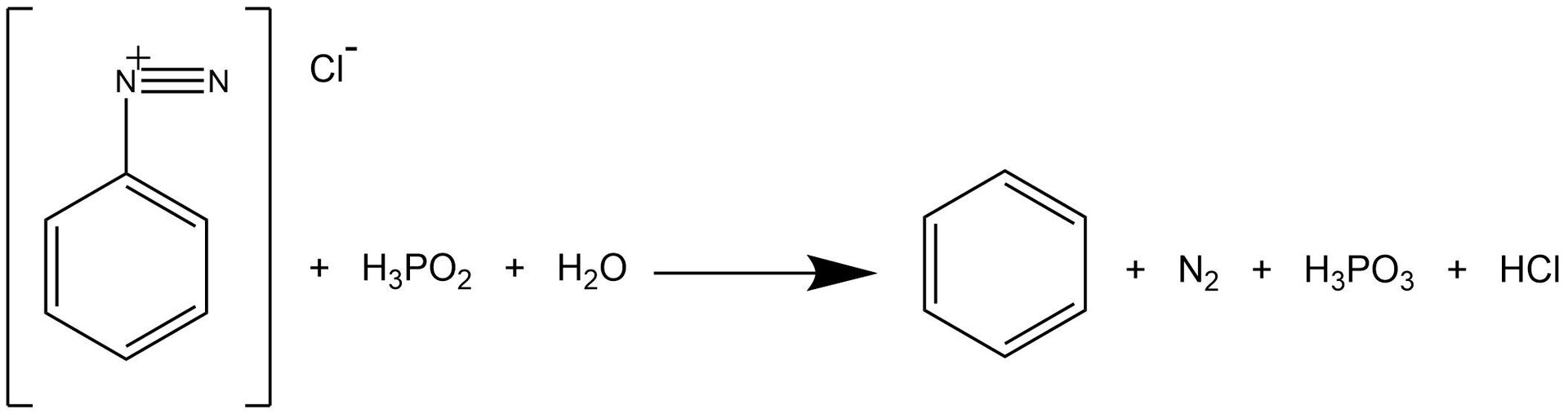
Dopiero po otrzymaniu soli diazoniowej można przejść do kolejnego etapu reakcji – otrzymywania benzenu.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/Dw0pQFIsD
Problem badawczy: Czy można otrzymać benzen w reakcji aniliny z azotanem(III) sodu?
Odczynniki chemiczne:
Przebieg eksperymentu:
Obserwacje:
Wyniki:
Wnioski:
Schemat reakcji chemicznych:
Odpowiedź zapisz w zeszycie do lekcji chemii, zrób zdjęcie, a następnie umieść je w wyznaczonym polu.
Na podstawie licznych badań, benzen został uznany za substancję rakotwórczą. W jego przypadku nie ma czegoś takiego, jak bezpieczny poziom narażenia – nawet niewielkie ilości tej substancji mogą wyrządzić szkody naszemu organizmowi. W przedstawionym laboratorium zastosowano metodę otrzymywania benzenu, która składa się z dwóch etapów. W pierwszym etapie zastosowano reakcję diazowania. W wyniku reakcji aminy aromatycznej (anilina) z kwasem azotowym (który został otrzymany w reakcji azotanu sodu z kwasem solnym) otrzymano sól diazoniową. Sole diazoniowe to grupa związków organicznych o wzorze ogólnym . Reakcja ta wymaga zastosowania odpowiednich warunków, aby mogła przebiec prawidłowo. Aromatyczne sole diazoniowe są trwałe w temperaturze od do , dlatego reakcja prowadzona jest w łaźni lodowej. Należy użyć nadmiaru kwasu solnego. Zapewnia on odpowiednie pH reakcji, które jest niezbędne do ustabilizowania soli diazoniowych.
Dopiero po otrzymaniu soli diazoniowej można przejść do kolejnego etapu reakcji – otrzymywania benzenu. Zapoznaj się z przeprowadzonym doświadczeniem i wykonaj ćwiczenia.
Analiza eksperymentu: Otrzymywanie benzenu.
Problem badawczy: Czy możliwe jest otrzymanie benzenu w reakcji soli diazoniowej z kwasem fosforowym?
Hipoteza: Można otrzymać benzen w reakcji soli diazoniowej z kwasem fosforowym.
Sprzęt laboratoryjny:
waga – urządzenie elektryczne służące do wyznaczania mas substancji. Daną substancję umieszcza się na srebrnej tacy umieszczonej na urządzeniu. Masa ważonej substancji wyświetlana jest na wyświetlaczu;
zlewka – naczynie szklane o kształcie cylindrycznym, stosowane do przeprowadzania prostych reakcji chemicznych;
cylindry miarowe – podłużne szklane naczynia laboratoryjne w kształcie walca z umieszczoną na ściance podziałką objętości. Służą do odmierzania cieczy;
pipety – wąska rurka do pobierania i przenoszenia niewielkiej ilości cieczy przy pomocy ssawki;
łyżeczki – długi trzonek wykonany ze szkła, porcelany lub metalu zakończony z jednej strony łyżeczką. Służy do nabierania sypkich substancji chemicznych;
kolba okrągłodenna – szklane naczynie laboratoryjne z zaokrąglonym dnem;
termometr ze szlifem – sprzęt laboratoryjny służący do pomiaru temperatury rozmaitych substancji, zwykle umieszczonych wewnątrz szklanej aparatury;
płaszcz grzewczy – sprzęt laboratoryjny służący do kontrolowanego podgrzewania zawartości kolb okrągłodennych, wykorzystywany często zamiast łaźni laboratoryjnej;
chłodnica Liebiga – rodzaj sprzętu laboratoryjnego pełniący funkcję skraplacza, czyli urządzenia zamieniającego gaz w ciecz lub (rzadko) gaz w ciało stałe;
kolba stożkowa – szklane naczynie laboratoryjne o kształcie stożka z płaskim dnem i wąską szeroką szyjką;
łaźnia lodowa – sprzęt laboratoryjny pośredniczący w chłodzeniu naczyń laboratoryjnych (wraz z ich zawartością). Łaźnia jest naczyniem wypełnionym odpowiednią substancją;
statyw – prostokątny sprzęt laboratoryjny z rzędami otworów, w których umieszczane są probówki.
Odczynniki chemiczne:
anilina;
azotan sodu;
kwas chlorowodorowy ;
kwas fosforowy ;
woda destylowana.
Przebieg eksperymentu.
Wprowadzono aniliny do kolby okrągłodennej, następnie dodano stężonego kwasu chlorowodorowego. Otrzymaną mieszaninę umieszczono w łaźni lodowej.
Przygotowano wodny roztwór azotanu sodu (rozpuszczono azotanu sodu w wody destylowanej). Roztwór wprowadzono do kolby okrągłodennej.
Do uzyskanej w kolbie okrągłodennej mieszaniny dodano kwasu fosforowego.
Po zakończeniu reakcji, przeprowadzono destylację prostą otrzymanego roztworu.
Podczas prowadzenia destylacji, zwrócono uwagę na temperaturę, w której destylują poszczególne składniki roztworu. Po wartości temperatury wrzenia określono, jaki produkt został otrzymany.
Obserwacje: Po dodaniu azotanu mieszanina znajdująca się w kolbie okrągłodennej przyjmuje pomarańczowy kolor. Następnie, po dodaniu kwasu fosforowego można zaobserwować wydzielanie się pęcherzyków bezbarwnego gazu. Podczas prowadzenia destylacji prostej analizowanej mieszaniny pierwszy składnik zaczyna wrzeć i skraplać się w kolbie stożkowej w temperaturze , jest to bezbarwna ciecz.
Wyniki: Otrzymana bezbarwna ciecz to benzen. Zostało to potwierdzone podczas destylacji prostej mieszaniny – temperatura wrzenia benzenu odpowiada temperaturze wrzenia bezbarwnej cieczy zbierającej się w kolbie stożkowej.
Wnioski: Hipoteza została potwierdzona – w reakcji soli diazoniowej z kwasem fosforowego możliwe jest otrzymanie benzenu.
Dokończ poniższe zdanie, wybierając prawidłową odpowiedź.