Przeczytaj
Czym są dipole?
Pomiędzy cząsteczkami działają siły przyciągania i odpychania. Nazwano je oddziaływaniami międzycząsteczkowymioddziaływaniami międzycząsteczkowymi. Wpływają one znacząco na właściwości substancji, w których występują (np. na temperaturę wrzenia i topnienia, stan skupienia, gęstość). Jednym z przykładów takiego oddziaływania jest oddziaływanie dipol–dipoloddziaływanie dipol–dipol, które występuje w cząsteczkach polarnych. Posiadają one ładunek cząstkowy (dodatni oraz ujemny), skoncentrowany w konkretnym obszarze związku chemicznego. Ponadto takie cząsteczki polarne charakteryzują się również stałym, elektrycznym momentem dipolowym. Ich bieguny (ładunki cząstkowe) decydują o orientacji w przestrzeni względem innych cząsteczek. Oddziaływanie dipol–dipol polega więc na elektrostatycznym przyciąganiu się przeciwnie naładowanych biegunów cząsteczek.
Dipol elektrycznyDipol elektryczny jest układem dwóch ładunków o równych wartościach i przeciwnych znakach, znajdujących się od siebie w pewnej odległości.

Jakie są przykłady dipoli?
Do dipoli zalicza się wiele cząsteczekcząsteczek z wiązaniem kowalencyjnym spolaryzowanym. Przykładami mogą być: , , , . Po stronie atomu wodoru znajduje się dodatni biegun dipola, a po stronie atomu fluorowca – ujemny. Takie substancje określa się jako polarne.

Jednak nie wszystkie cząsteczki, w których występuje wiązanie spolaryzowane, są dipolami. Moment dipolowy cząsteczki jest sumą wektorów momentów dipolowych poszczególnych wiązań w cząsteczce. Jeśli poszczególne momenty dipolowe wiązania znoszą się wzajemnie, to cząsteczka nie posiada wcale momentu dipolowego. Przykładem jest dwuatomowa, liniowa cząsteczka . Każde wiązanie jest polarne, jednak eksperymenty pokazują, że cząsteczka tlenku węgla() nie posiada momentu dipolowego. Dzieje się tak, ponieważ dwa dipole wiązania , równe pod względem wielkości oraz zorientowane względem siebie pod kątem , znoszą się wzajemnie. Zerowy moment dipolowy występuje również w cząsteczce czteroatomowej – czy tetraedrycznej .
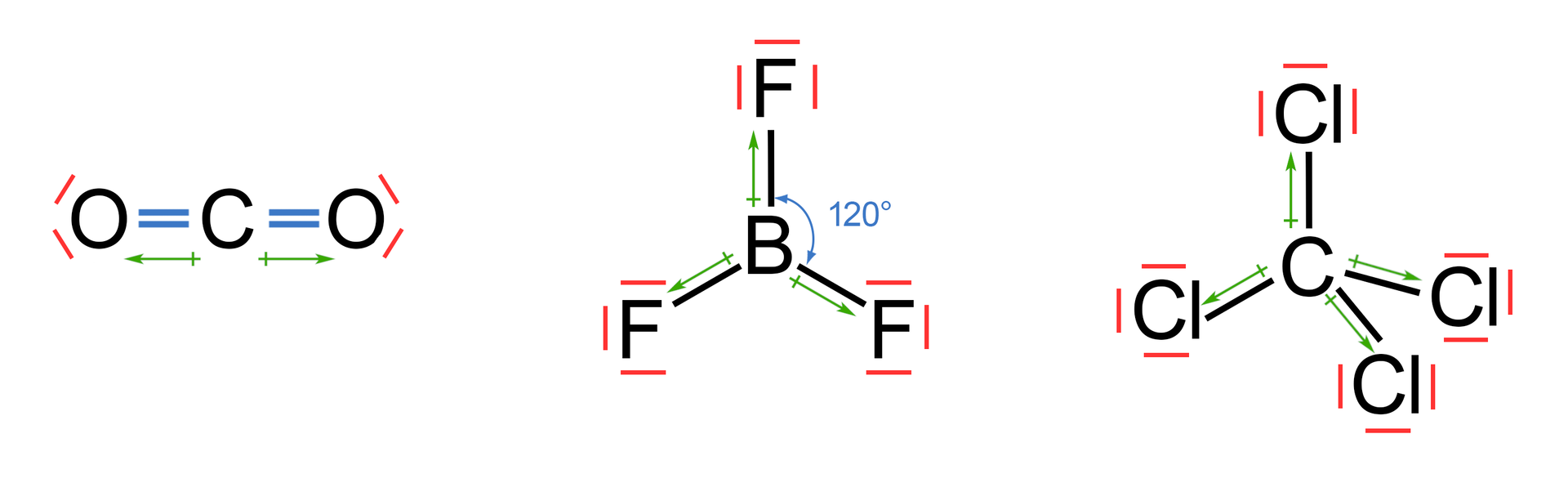
Cząsteczka o kształcie piramidy, np. amoniak, jest dipolem, ponieważ na atomie azotu, w miejscu występowania wolnej pary elektronowej, jest większa gęstość ładunku ujemnego niż po stronie atomów wodoru.

Silniejszy charakter dipolowy posiadają cząsteczki wody, ponieważ wiązanie jest bardziej spolaryzowane niż wiązanie . Dodatkowo atom tlenu posiada dwie wolne pary elektronowe.

Ładunki elektryczne o przeciwnych znakach przyciągają się, a o takich samych odpychają, dlatego także dipole mogą się przyciągać lub odpychać, w zależności od wzajemnej orientacji. Bardziej korzystne energetycznie jest przyciąganie, dlatego cząsteczki będące dipolami ustawiają się właśnie w taki sposób. Jest to oddziaływanie dipol–dipol.

Jakie są skutki występowania oddziaływań dipol–dipol?
Ciecze, w których występuje silne oddziaływanie międzycząsteczkowe, posiadają duże entalpie parowania oraz wysokie temperatury wrzenia. Dzięki znajomości tej temperatury można uzyskać informacje o względnej sile oddziaływań międzycząsteczkowych.
Substancje polarne są dobrymi rozpuszczalnikami dla innych substancji polarnych (zgodnie z zasadą „podobne rozpuszcza się w podobnym”). Na przykład woda stanowi dobry rozpuszczalnik dla amoniaku.
Oddziaływania dipol–dipol występują pomiędzy grupami polarnymi w białkach, stabilizując ich trzeciorzędową strukturę. Grupy polarne, zawarte w białku, mogą tworzyć oddziaływania dipol–dipol.
Słownik
w przestrzeni trójwymiarowej powierzchnia, w obrębie której potencjał elektryczny jest równy (ma jednakową wartość)
układ dwóch ładunków punktowych o równych wartościach i przeciwnych znakach, znajdujących się w pewnej odległości od siebie
przyciąganie oraz odpychanie, występujące pomiędzy atomami sąsiadujących cząsteczek
wektor o kierunku zgodnym z osią dipola, umownym zwrocie od ładunku ujemnego do dodatniego; jego wartość jest równa iloczynowi ładunku i odległości między ładunkami
elektrostatyczne oddziaływanie cząsteczek polarnych, odpowiednio zorientowanych wobec siebie
cząsteczka, w której występują dwa przeciwnie naładowane bieguny
Bibliografia
Atkins P., Jones L., Chemical Principles: The Quest for Insight, 5 th Edition, New York 2009.
Penkala T., Podstawy chemii ogólnej, Warszawa 1982.