Przeczytaj
Rola związków miedzi
Spośród całkowitej światowej produkcji, związki miedzi stanowią niewielki odsetek – w porównaniu do jej stopów oraz metalicznej miedzi. Mimo wszystko związki te odgrywają ważną i zróżnicowaną rolę w różnych gałęziach przemysłu i w rolnictwie. Niska toksyczność związków miedzi względem zwierząt i roślin wyższych sprawiła, że był to jeden z pierwszych znanych środków grzybobójczych. Obecnie ten trend jest utrzymywany. Miedź tworzy szereg różnych związków chemicznych. Wśród nich wyróżnia się związki miedzi na i stopniu utlenienia oraz związki kompleksowe na i stopniu utlenienia.
Tlenek miedzi()

Związek ten powstaje również w wyniku działania substancji redukujących – takich jak aldehydy, cukry, ale również hydrazyny czy hydroksyloaminy – na mieszaninę zawierającą świeżo strącony wodorotlenek miedzi() lub związki kompleksowe miedzi() w roztworze o odczynie zasadowym. Tę właściwość wykorzystuje się w czterech próbach: TrommeraTrommera, FehlingaFehlinga, Benedicta oraz w próbie Barfoeda, które stosowane są w celu wykrywania i ilościowego oznaczania aldehydów oraz cukrów. Pozwalają one odróżnić ketony od aldehydów, dlatego stosuje się je między innymi w analityce laboratoryjnej. Przykładowo, w wyniku próby Trommera, najczęściej wykorzystywanej i spotykanej w czasie szkolnej nauki chemii, zachodzi następujący proces redukcji:
Co więcej, to właśnie stosowany jest w rolnictwie jako środek grzybobójczy (dla nasion i roślin uprawnych), ale także jako katalizator w reakcjach organicznych, dodatek do nawozów, pigment do ceramiki, szkła i tworzyw sztucznych, adsorbent tlenku węgla(). W postaci farb wykorzystywany jest do pokrywania den łodzi i statków w celu ochrony przed pąklami i glonami.
Na czym polega próba Fehlinga?
Próba Fehlinga wymaga zastosowania kompleksów winianowych miedzi(). Kompleksy te otrzymuje się w wyniku zmieszania roztworu siarczanu() miedzi() (roztwór Fehlinga ) z zasadowym roztworem winianu potasowo‑sodowego () (roztwór Fehlinga ). Ogrzewanie tego roztworu z cukrami prostymi i dwucukrami o właściwościach redukujących prowadzi do wytrącenia ceglastoczerwonego osadu tlenku miedzi() (osad początkowo ma barwę żółtą, będąc w stanie dużego rozdrobnienia).
Na czym polega próba Benedicta
Podobnie jak w próbie Fehlinga, próba Benedicta ukazuje właściwości redukujące niektórych cukrów (z wolnymi grupami karbonylowymi) poprzez wytrącenie ceglastoczerwonego tlenku miedzi(). W tym celu stosowany jest odczynnik Benedicta, który składa się z soli miedzi (siarczanu() miedzi()), alkalizującego węglanu sodu oraz cytrynianu sodu w celu zapobiegania wytrącania się wodorotlenku miedzi(). Próba ta jest znacznie bardziej precyzyjna w porównaniu do próby Fehlinga, ponieważ już stężenie cukru o wartości powoduje zmianę barwy (z niebieskiej na zieloną – zmieszanie barwy niebieskiej z ceglastoczerwoną). Ponadto jest ona bardziej selektywna względem cukrów, ponieważ chloroform, kreatynina i kwas moczowy nie ulegają redukcji przez ten odczynnik.
Barwa i osad | Przybliżona zawartość cukru [] |
|---|---|
zielona, bez osadu | – |
zielona, osad | |
żółtozielona, osad | |
pomarańczowa, osad | |
czerwona, osad |
Indeks dolny Źródło: Wydział Chemii Uniwersytetu Gdańskiego, chemia.ug.edu.pl, dostęp: 03.06.2020. Indeks dolny koniecŹródło: Wydział Chemii Uniwersytetu Gdańskiego, chemia.ug.edu.pl, dostęp: 03.06.2020.
Próba Barfoeda
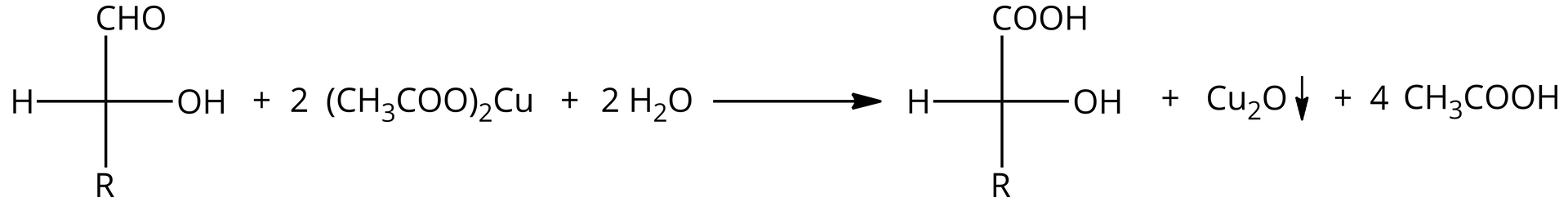
Próba ta jest modyfikacją próby Benedicta. Do redukcji jonów miedzi wykorzystywany jest octan miedzi() (etanian miedzi()). Reakcja przebiega znacznie wolniej niż wspomniana powyżej próba Benedicta.
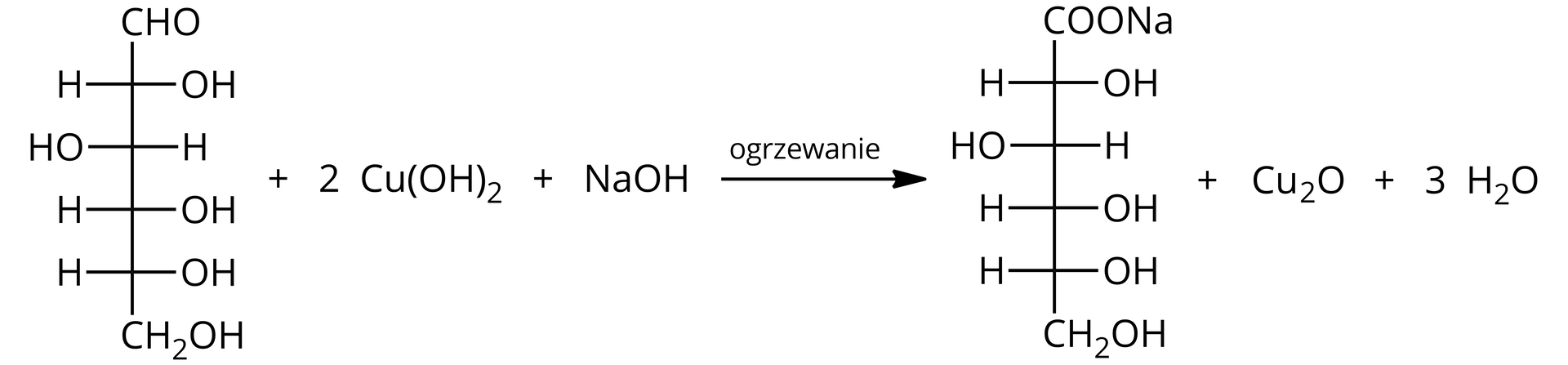
Doświadczenie: przeprowadź próbę Trommera
Wykonaj próbę Trommera dla roztworu glukozy i dla soku z winogron.
W tym celu do około analizowanego roztworu dodaj roztwór zawierający wodorotlenek miedzi(), przygotowany in situ, czyli roztworu otrzymanego w wyniku zmieszania kropli roztworu z roztworu o stężeniu .
Następnie tak przygotowaną próbkę ogrzej, doprowadzając do wrzenia.
Wytrącenie ceglastoczerwonego osadu tlenku miedzi() będzie świadczyć o obecności redukujących właściwościach cukru.
Zastosowanie innych związków miedzi
Słownik
reakcja charakterystyczna stosowana w celu jakościowego oznaczania aldehydów; polega ona na reakcji redoks wodorotlenku miedzi() z aldehydami, w wyniku której aldehydy ulegają utlenieniu do kwasów karboksylowych (a właściwie ich soli), a jony miedzi() redukują się do miedzi() – powstaje ceglastoczerwony osad tlenku miedzi()
reakcja charakterystyczna stosowana w celu jakościowego oznaczania aldehydów; polega ona na reakcji redoks jonów miedzi() do miedzi() – tlenek miedzi() jest ceglastoczerwonym osadem; stosowanym odczynnikiem są kompleksy winianowe miedzi(); zastosowany kompleks miedzi() jest bardziej reaktywny i lepiej rozpuszczalny w porównaniu do wodorotlenku miedzi(), stosowanego w próbie Trommera
środek grzybobójczy do ochrony zbóż, kwiatów, drzew owocowych
proces usuwania związków tiolowych z ropy naftowej i jej pochodnych poprzez ich utlenienie do disiarczków o mniejszej szkodliwości i większej lepkości, co sprzyja usuwaniu związków siarki z lekkich frakcji ropy naftowej i ich akumulacji w cięższych frakcjach ropy naftowej; do procesu słodzenia wykorzystuje się chlorek miedzi()
Bibliografia
Atkins P., Jones L., Chemical Principles: The Quest for Insight, fifth edition, New York 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Richardson H. W., Handbook of Copper Compounds and Applications, USA 1997.
Introduction to Electron Paramagnetic Resonance, chlorek miedzi() EPR, online: onlinelibrary.wiley.com, dostęp: 09.07.2021.
Petrolelum products and their uses, online: britannica.com, dostęp: 09.07.2021.
Zasiewanie chmur–jodek miedzi(), s. 83, online: books.google.pl, dostęp: 09.07.2021.