Przeczytaj
Stany skupienia a parametry stanu
Z doświadczeń i obserwacji wiemy, że ta sama substancja może znajdować się w różnych stanach, zwanych fazami, o całkowicie odmiennych własnościach fizycznych. Liczba faz w układzie termodynamicznym zależy od parametrów stanu, takich jak ciśnienie (p), temperatura (T), stężenie (c), objętość (V) oraz gęstość (rho).
Poniższy wykres zależności ciśnienia (p) od temperatury (T) przedstawia diagram fazowy dla wody. Określa on warunki temperatury i ciśnienia, w których istnieją różne stałe, ciekłe i gazowe fazy czystej substancji. Na jego podstawie, dla układu jednoskładnikowego – np. dla wody (diagram widoczny poniżej), można dowiedzieć się, w jakiej fazie występuje substancja (woda) dla danej wartości ciśnienia i temperatury. Widoczne na rysunku linie czerwone określają granicę występowania danej fazy (lodu, cieczy oraz gazu), czyli zakres temperatury i ciśnienia, w którym występuje dana faza.
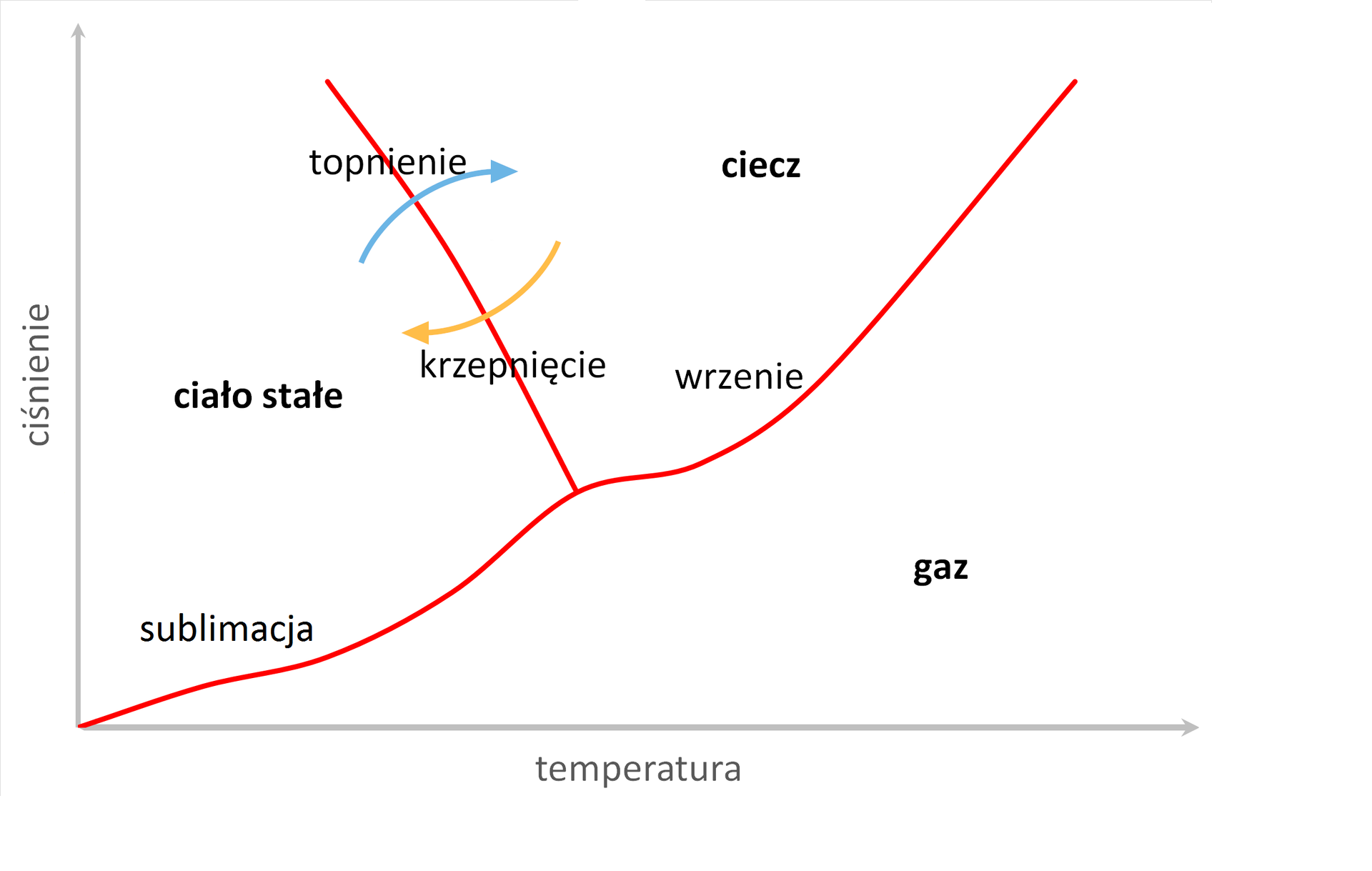
Zmieniając dany parametr dla konkretnej fazy, np. zwiększając ciśnienie dla pary wodnej w odpowiednim zakresie temperatur, możemy zaobserwować przemianę fazową pary wodnej (gazu) w lód (ciało stałe) – jest to proces resublimacji, co przedstawiono na poniższym rysunku.

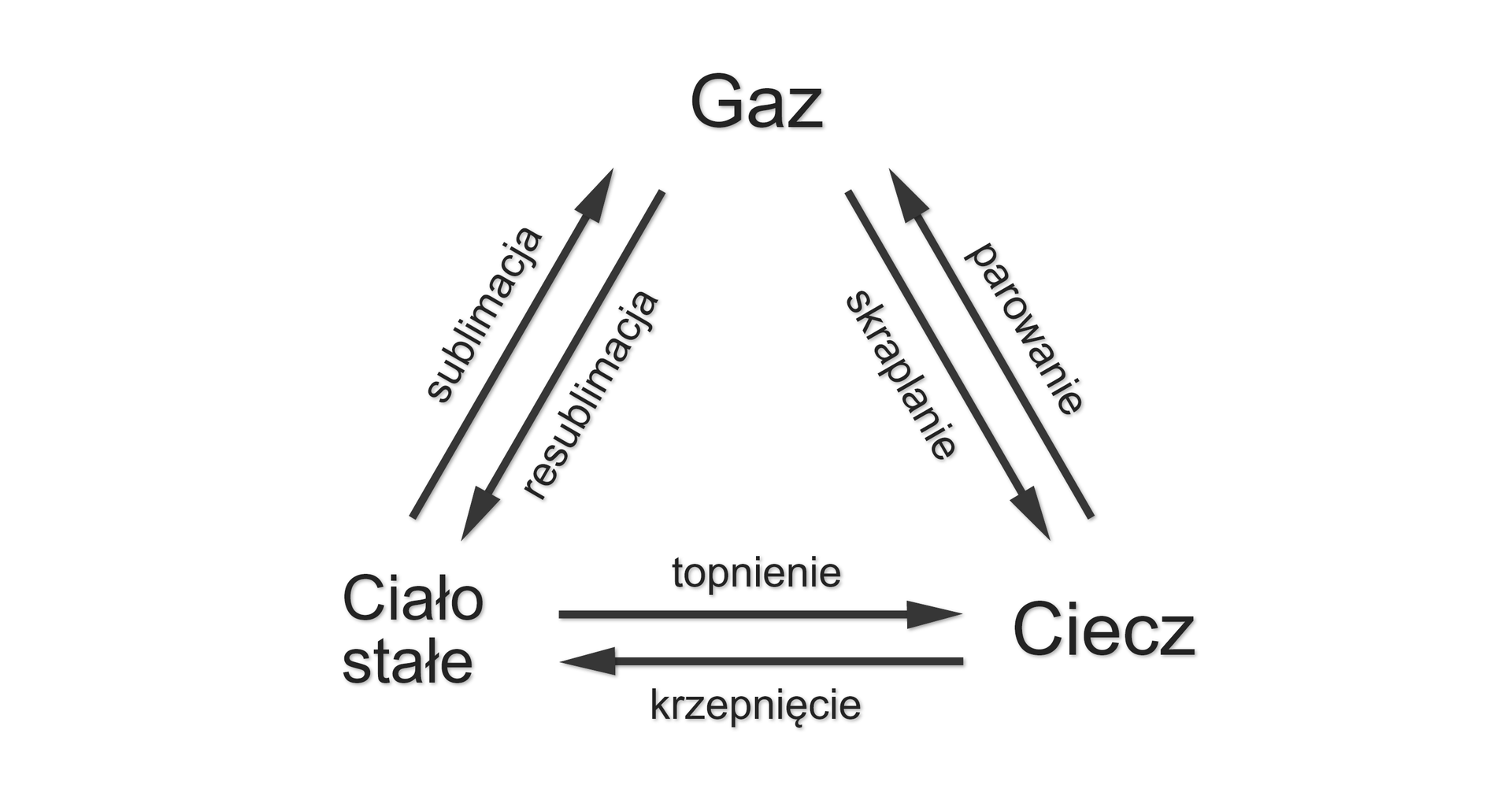
Wyróżniamy następujące przejścia między fazą stałą, ciekłą i gazową:
ciecz → gaz: parowanie;
gaz → ciecz: skraplanie;
ciało stałe → gaz: sublimacja;
gaz → ciało stałe: resublimacja;
ciecz → ciało stałe: krzepnięcie;
ciało stałe → ciecz: topnienie.
Uporządkowanie cząsteczek
Zależnie od fazy, mamy różne uporządkowanie cząsteczek. Jak widać na poniższym rysunku, w stanie gazowym cząsteczki są najbardziej nieuporządkowane.

W stanie gazowym ruch termiczny cząstek jest najszybszy i jest on chaotyczny (przypadkowy), czyli nie ma żadnego uporządkowania. W cieczach obserwujemy znacznie wolniejsze ruchy termiczne cząstek, o wiele większą gęstość, a także pewien stopień uporządkowania; oddziaływania międzycząsteczkowe pomiędzy cząsteczkami (np. wiązania wodorowe), które występują w stanie ciekłym, są znacznie większe niż pomiędzy cząsteczkami w stanie gazowym. Natomiast w ciałach stałych/kryształach, cząstki są nieruchome i znajdują się w węzłach sieci. Jedyne, co można zaobserwować, to drgania cząstek (tzw. drgania, oscylacje) lub ruch elektronów (zwłaszcza w metalach) przy niskich energiach (temperaturach). Najbardziej uporządkowaną formą materii jest ciało doskonale krystaliczne.
Dla substancji czystej można stwierdzić, że:
ciało stałe – posiada wysoki stopień uporządkowania atomów, jonów lub cząsteczek → niska entropiaentropia;
ciecz – wartość entropii jest wyższa od wartości entropii ciała stałego, ale niższa od wartości odpowiadającej gazowi;
gaz – nie ma żadnego uporządkowania → wysoka entropia.
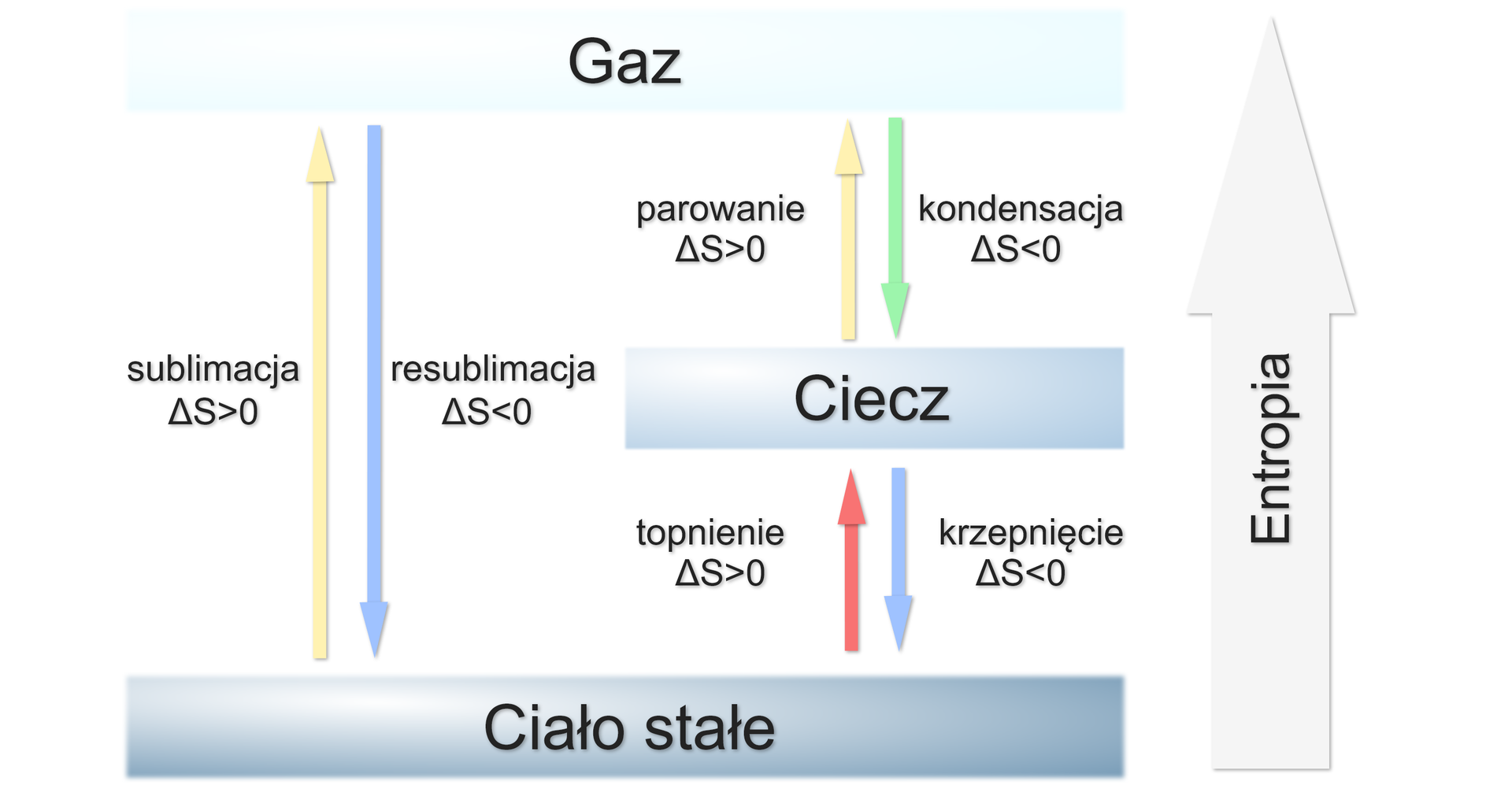
Entropia (oznaczana symbolem S) jest miarą „nieuporządkowania”. Przy wzroście stopnia nieuporządkowania oraz ze wzrostem temperatury, entropia układu rośnie. W miarę obniżania temperatury, stopień nieuporządkowania maleje do zera. Wszelkie przemiany, prowadzące do wzrostu nieuporządkowania, wykazują dodatnią zmianę entropii (układu). Na poniższym rysunku można zauważyć, że dla takich procesów, jak sublimacja, topnienie oraz parowanie, którym towarzyszy zwiększenie nieuporządkowania cząstek, następuje wzrost entropii.
Obliczanie zmiany entropii
Chcąc obliczyć zmianę entropii podczas przebiegu danej reakcji czy przemiany fazowejprzemiany fazowej, można zastosować wzór z wykorzystaniem stabelaryzowanych wartości standardowych molowych entropii poszczególnych substratów i produktów.
Dla danej reakcji chemicznej:
Gdzie , , i oznaczają współczynniki stechiometryczne reagentów.
Słownik
termodynamiczna funkcja stanu, określająca kierunek przebiegu procesów spontanicznych (samorzutnych) w odosobnionym układzie termodynamicznym; jest miarą stopnia nieuporządkowania układu i rozproszenia energii
część przestrzeni materialnej, będącej przedmiotem rozważań; pozostała część przestrzeni jest otoczeniem
część lub całość układu, która wykazuje w całej swej masie jednakowe własności fizyczne i chemiczne (w szczególności jednakowe równanie stanu) i jest oddzielona wyraźnie od reszty układu (otoczenia)
samorzutna przemiana jednej fazy w drugą
układ złożony tylko z jednej fazy (stałej, ciekłej lub gazowej) substancji; lód jest przykładem układu jednofazowego i jednoskładnikowego
układ złożony z więcej niż jednej fazy, np. układ złożony z wody i lodu, zawierający tylko jeden składnik, ale dwie fazy; przykładem układu wielofazowego i wieloskładnikowego może być naczynie z wodą, do której dodano rtęć
Bibliografia
Atkins P. W., Chemia fizyczna, Warszawa 2006.
Gumiński K., Termodynamika, wyd. 3, Warszawa 1974.
Orear J., Fizyka, Warszawa 1993.
Stauffer D., Stanley H. E., Od Newtona do Mandelbrota, Warszawa 1996.