Przeczytaj
Czym są związki kompleksowe?
Związki kompleksowe powstają poprzez utworzenie wiązania pomiędzy ligandemligandem a jonem (atomem) centralnym. Charakteryzują się one tym, że:
wiązania koordynacyjne, łączące ligandy z jonem (atomem) centralnym, utworzone zostają przez parę elektronową pochodzącą od liganda;
ligandy i jon (atom) centralny mogą istnieć niezależnie jako trwałe drobiny (cząsteczki lub jony).
Wobec tego, oprócz typowych kompleksów w rodzaju (anionu tetrahydroksoglinianowego), (anionu heksacyjanożelazianowego()) lub (kationu heksaakwamanganu()), do tej grupy można także zaliczyć (jon amonu) czy (anion trijodkowy), a także inne cząsteczki/jony utworzone w wyniku reakcji między kwasem a zasadą w ujęciu LewisaLewisa. Reakcję powstawania kompleksu przedstawiono poniżej:

Do najpowszechniejszych ligandów zalicza się:
cząsteczki wody () i jony wodorotlenkowe (), w których atomem donorowym jest atom tlenu;
cząsteczki amoniaku (), w których atomem posiadającym wolną parę elektronową i donorem tej pary jest atom azotu.
Ligand akwa
Gdy ligandem w kompleksie jest cząsteczka wody, mówi się o obecności liganda akwa w kompleksie. Cząsteczka wody posiada dwie wolne pary elektronowe należące do atomu tlenu. Dzięki temu może pełnić rolę zasady Lewisa w tworzeniu się wiązania koordynacyjnego. Ligand akwa jest ligandem obojętnym, zatem nie wpływa na ładunek jonu kompleksowego
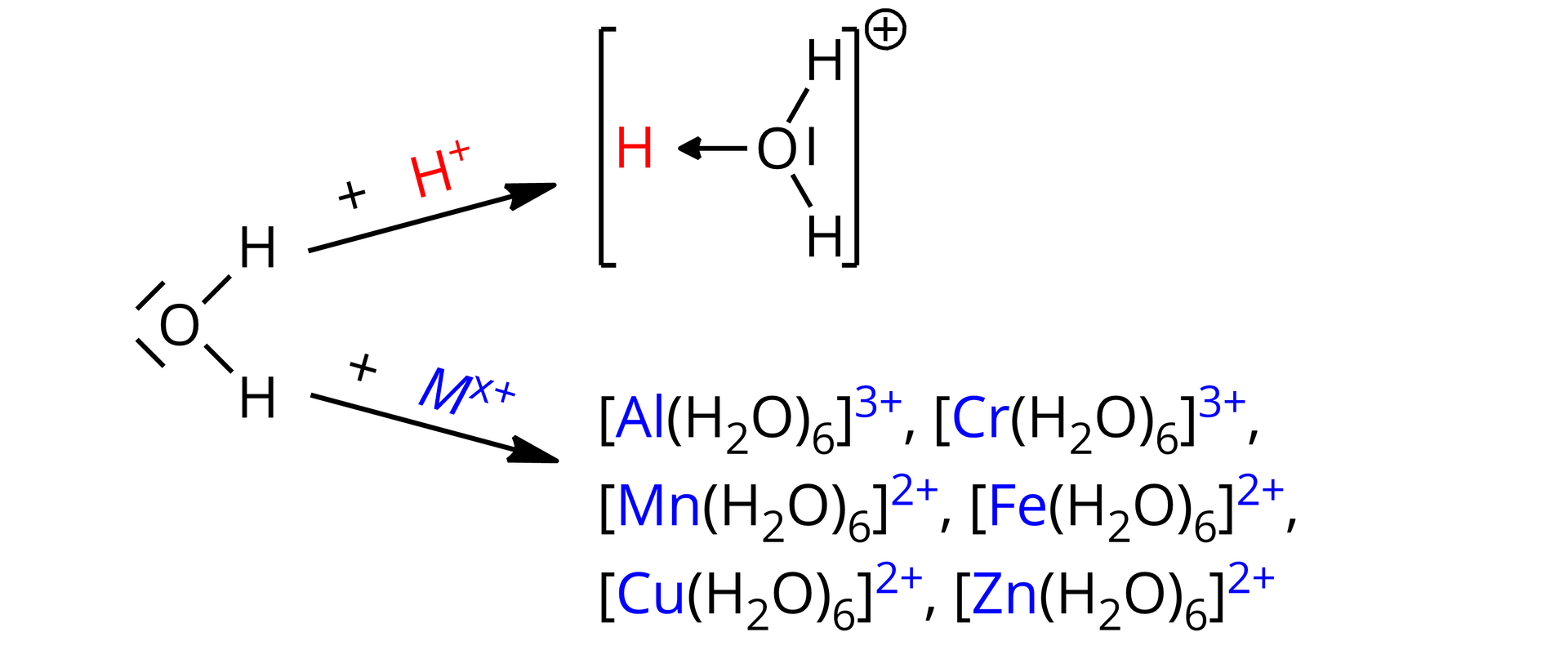
Jon H+/M x+ pełni rolę kwasu Lewisa – akceptor pary elektronowej.
Tworzenie się akwakompleksówakwakompleksów zachodzi powszechnie w wodnych roztworach kationów metali, gdzie kationy te stanowią jon centralny powstających kompleksów. Zatem zapisywanie wzoru kationu metalu w reakcji dysocjacji jego soli jest jedynie uproszczeniem – w rzeczywistości kationy te raczej nie są obserwowane w stanie wolnym. W formie akwakompleksów występują także hydraty kationów metali w postaci kryształów.
Innym powszechnym akwakompleksem jest jon powstający w wyniku autodysocjacji wody oraz w wyniku dysocjacji kwasów, czyli jon oksoniowy: . Powstaje on wskutek akceptacji przez jon wodoru pary elektronowej należącej do atomu tlenu w cząsteczce wody. Proces tworzenia się tych kompleksów jest tak szybki, że w roztworze wodnym wolne jony wodoru w zasadzie nie występują. Dlatego pomiar pH, którego wartości uzyskuje się poprzez badanie stężenia jonów wodoru w roztworze, tak naprawdę sprawdza stężenie jonów oksoniowych.
Ligand hydrokso
W roztworach wodnych o zasadowym pH ligandami dla jonu centralnego mogą stać się jony wodorotlenkowe. W ich przypadku atom tlenu posiada aż trzy wolne pary elektronowe, mogące utworzyć wiązanie koordynacyjne. Ligand hydrokso jest ligandem ujemnym, zatem obniża ładunek jonu kompleksowego.

Jon H+/M x+ pełni rolę kwasu Lewisa – akceptor pary elektronowej.
Jednymi z najpopularniejszych hydroksokompleksówhydroksokompleksów są kompleksy metali o charakterze amfoterycznym, takich jak cynk czy glin. Powstają one np. w wyniku reakcji wodorotlenków tych metali z wodnymi roztworami wodorotlenków będących mocnymi elektrolitami. Co więcej, w niektórych przypadkach stężenie tych mocnych elektrolitów wpływa na liczbę ligandów przyjmowanych przez kation metalu, np. w przypadku glinu:
Co więcej, podwyższenie pH roztworu zawierającego kationy metali prowadzi do wymiany cząsteczek wody w akwakompleksach na jony wodorotlenkowe, a proces ten zachodzi szybciej w sytuacji, gdy ilość cząsteczek wody związanej z jonem centralnym jest większa, a pH roztworu jest wyższe. Warto zauważyć, że większość akwakompleksów wykazuje charakter kwasowy, bowiem w wodnym roztworze o obojętnym pH dochodzi do deprotonacji jednej z cząsteczek wody, będących ligandami.
gdzie:
– kation metalu;
– ładunek jonu kompleksowego,
W przypadku akwakomplesów niektórych metali, deprotonacji w takich warunkach ulegają nawet dwie cząsteczki wody. Czasami deprotonacji towarzyszy wytrącanie się osadu akwahydroksokompleksu, jak w przypadku jonu miedzi():
Wzór wytrącającego się kompleksu zapisuje się w uproszczeniu jako wodorotlenek metalu lub uwodniony tlenek metalu.
Obniżenie pH natomiast prowadzi do protonacjiprotonacji jonów wodorotlenkowych w kompleksie i odtworzenia akwakompleksu. W analogiczny sposób zachodzi reakcja neutralizacji w roztworze o charakterze zasadowym, kiedy to anion wodorotlenkowy staje się donorem wiązania koordynacyjnego dla jonu wodoru, pochodzącego np. od mocnego kwasu dodanego do roztworu lub od obecnych w roztworze kationów oksoniowych:
Warto też zaznaczyć, że niektóre jony metali nie tworzą hydroksokompleksów, jak na przykład jony kobaltu(), kobaltu() czy niklu().
Ligand amina
W wyniku dodania amoniaku do roztworu zawierającego jony metali może dojść do powstania aminakompleksów, gdzie cząsteczki amoniaku pełnią rolę ligandów. Atom azotu w cząsteczce amoniaku posiada bowiem jedną wolną parę elektronową, która może brać udział w tworzeniu wiązania koordynacyjnego.
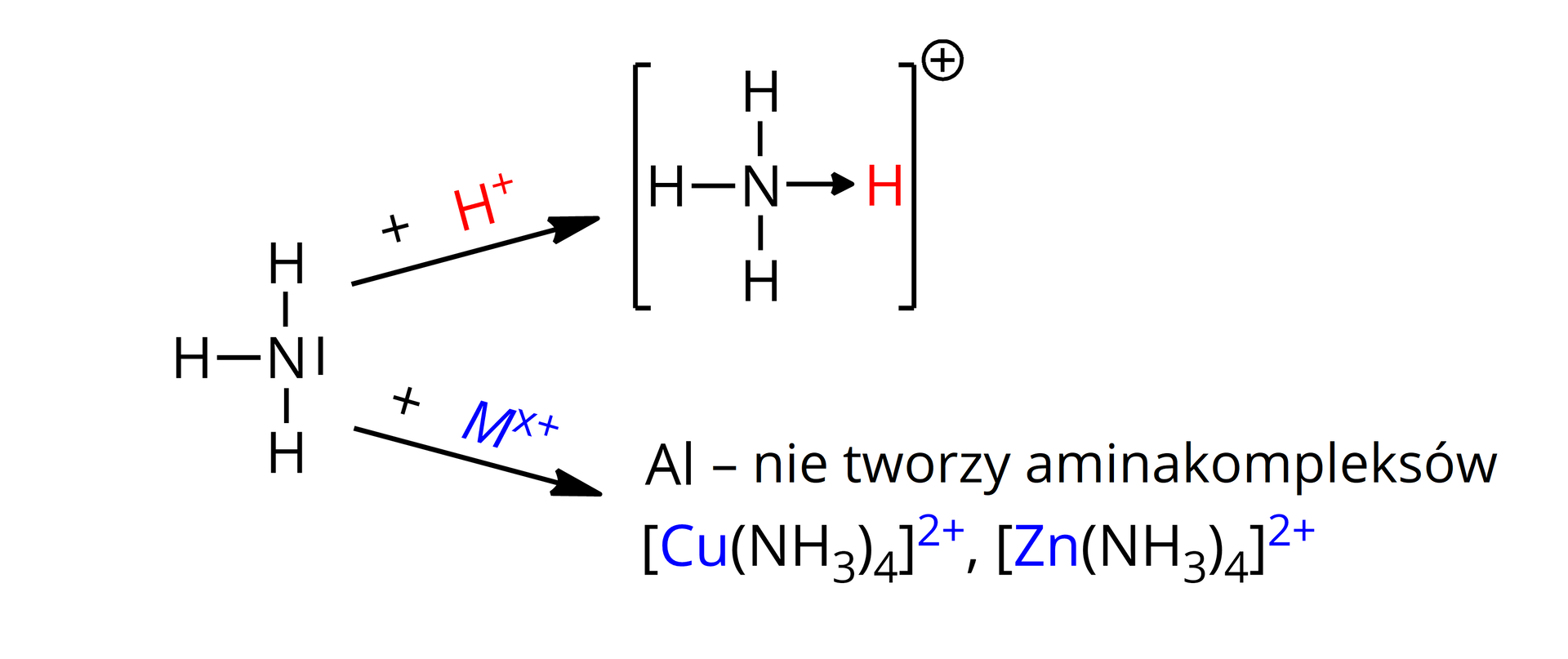
Jon H+/M x+ pełni rolę kwasu Lewisa – akceptor pary elektronowej.
Aminakompleksy mogą powstawać, gdy do trudno rozpuszczalnej soli dodany zostanie nadmiar amoniaku, jak w przypadku chlorku srebra():
W reakcji tej powstaje chlorek diaminasrebra() – dobrze rozpuszczalna sól, która dysocjuje na jony:
Innym przykładem powstawania aminakompleksów jest podmiana (substytucja) cząsteczek wody w akwakompleksach przez cząsteczki amoniaku w sytuacji, gdy aminakompleksy danego metalu charakteryzują się większą trwałością niż akwakompleksy, jak w przypadku jonu tetraakwamiedzi():
Podobnie jak w przypadku liganda hydrokso, nie wszystkie jony metali tworzą aminaakompleksy. Należą do nich m. in. jony glinu oraz jony żelaza().
Słownik
teoria kwasowo‑zasadowa, w której kwas jest biorcą (akceptorem) pary elektronowej, zaś zasada – dawcą (donorem) pary elektronowej
donory (dawcy) pary elektronowej do utworzenia wiązania koordynacyjnego
kompleksy zawierające ligand , np. ,
kompleksy zawierające ligand , np. ,
kompleksy zawierające ligand , np. ,
przyłączenie jonu (jonu wodoru) przez zasadę Brønsteda
teoria kwasowo‑zasadowa, w której kwas jest dawcą (donorem) jonu wodoru, zaś zasada – biorcą (akceptorem) jonu wodoru
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1997.