Przeczytaj
Jednym ze sposobów klasyfikacji kwasów jest ich podział. Wyróżniamy kwasy mocne oraz słabe. Podstawą do określenia mocy kwasu jest przebieg jego dysocjacji jonowej, a w związku z tym wartość stałej dysocjacjistałej dysocjacji . Wszystkie rozpuszczalne w wodzie kwasy ulegają dysocjacji jonowej. Jeżeli proces ten przebiega praktycznie w 100%, można je wówczas uznać za mocne kwasymocne kwasy. Jeżeli natomiast dysocjacja zachodzi w niewielkim stopniu, to mamy doczynienia z kwasem słabymkwasem słabym.
Mocne kwasy
Mocne kwasy to elektrolityelektrolity, które w roztworze wodnym są całkowicie lub prawie całkowicie zdysocjowane. Dzieli się je na tlenowe oraz beztlenowe.

W roztworach tych kwasów nie ma więc cząsteczek , , , , , , lecz jedynie jony , , , , , , , , tak jak przedstawiono na poniższych równaniach dysocjacji elektrolitycznej.
,
,
,
,
,
Zwróć uwagę, że wartości stałych dysocjacji są bardzo wysokie, co oznacza, że równowaga reakcji jest praktycznie całkowicie przesunięta w stronę produktów, czyli powstających jonów.
Kwas siarkowy() jest kwasem dwuprotonowym, więc dysocjuje dwustopniowo. Pierwszy etap dysocjacji zachodzi w dużym stopniu, o czym świadczy wysoka wartość stałej dysocjacji. Drugi etap natomiast zachodzi w małym stopniu, dlatego powstające po dysocjacji jony , odpowiedzialne za odczyn kwasowy, pochodzą w większości z pierwszego etapu.
W przypadku zapisu równań dysocjacji elektrolitycznej mocnych kwasów, stosuje się jedną strzałkę, oznaczającą praktycznie całkowitą dysocjację kwasu. Wyjątkiem jest drugi etap dysocjacji kwasu siarkowego(), w którym zapisuje się obie strzałki.
Słabe kwasy
Kolejną grupą są kwasy, stanowiące słabe elektrolity. Kwasy te ulegają dysocjacji w znacznie mniejszym stopniu niż mocne kwasy. Tylko niewielki ułamek cząsteczek rozpada się na jony, a reszta pozostaje w roztworze pod postacią cząsteczek niezdysocjowanych. Kwasami słabymi są m.in.: , , , , , , itd.
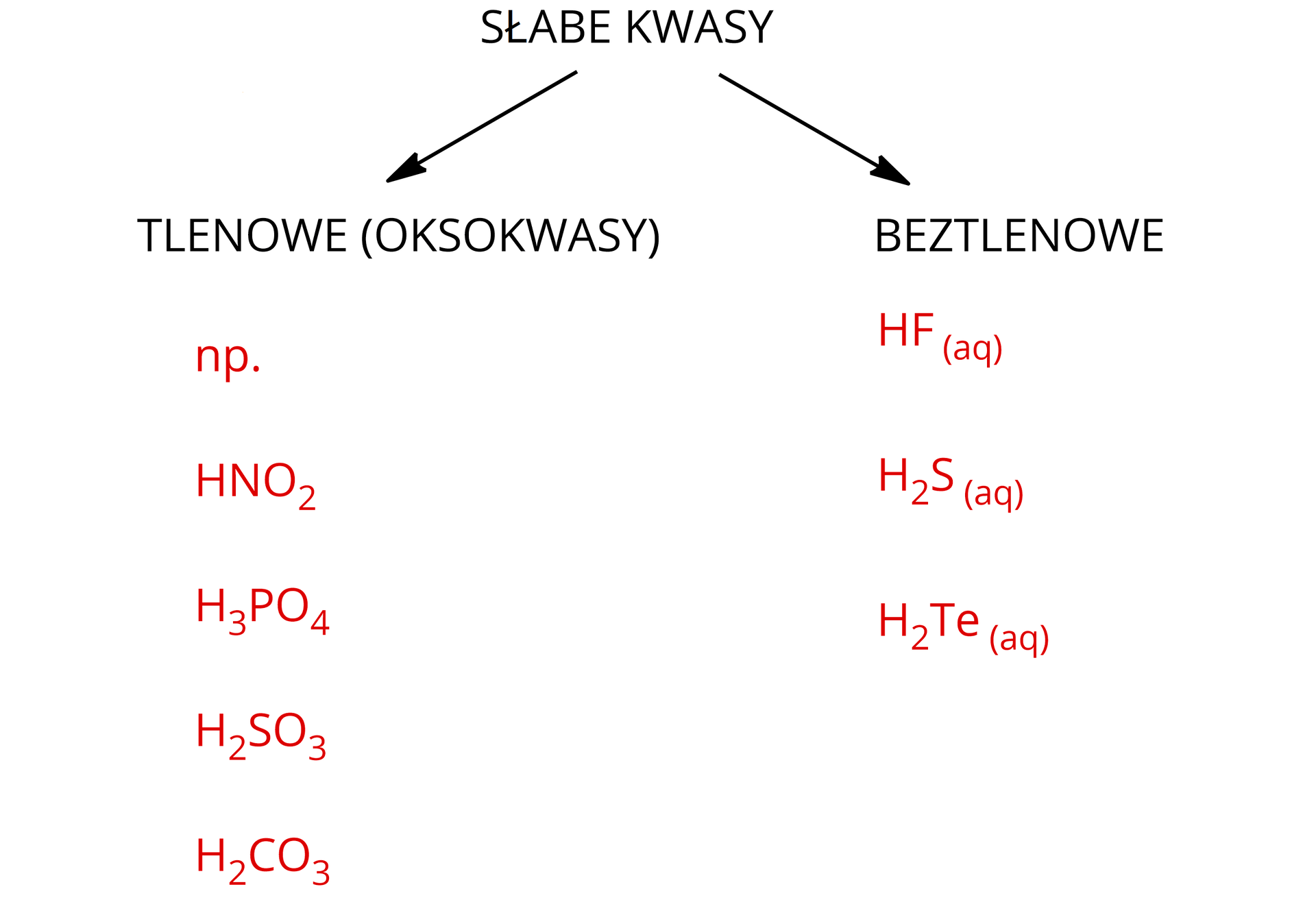
W roztworach tych kwasów są więc zarówno cząsteczki, np.: , , ,
, jak i jony: , , , , , , tak jak przedstawiono na poniższych równaniach dysocjacji elektrolitycznej.
Wartości stałych dysocjacji słabych kwasów są znacznie niższe niż mocnych kwasów, a równowaga dysocjacji elektrolitycznej jest znacznie przesunięta w stronę substratów.
,
,
,
W przypadku zapisu równań dysocjacji elektrolitycznej słabych kwasów, stosuje się strzałki w obie strony, świadczące o niecałkowitej dysocjacji kwasów. W przypadku kwasów wieloprotonowych, dysocjacja zawsze zachodzi wieloetapowo.
Moc kwasów beztlenowych i tlenowych
- wzrasta wraz ze wzrostem liczby atomowej atomu centralnego (wraz ze zmniejszaniem się elektroujemności niemetalu)
- wzrasta wraz ze wzrostem elektroujemności atomu centralnego reszty kwasowej
- wzrasta ze wzrostem liczby atomów tlenu
Moc kwasów beztlenowych
- wzrasta wraz ze wzrostem liczby atomowej atomu centralnego (wraz ze zmniejszaniem się elektroujemności niemetalu)
Moc kwasów tlenowych (oksokwasów)
- wzrasta wraz ze wzrostem elektroujemności atomu centralnego reszty kwasowej
- wzrasta ze wzrostem liczby atomów tlenu
Słownik
substancja przewodząca prąd dzięki obecności swobodnie poruszających się jonów
kwas, który ulega praktycznie całkowitej dysocjacji, np.: , , , , ,
kwas, który ulega dysocjacji w niewielkim stopniu, np.: , , ,
stosunek liczby cząsteczek (lub jonów), które uległy dysocjacji elektrolitycznej, do liczby cząsteczek elektrolitu wprowadzonych do roztworu; wartość zależy m.in. od stężenia elektrolitu
stosunek iloczynu stężeń jonów powstających podczas dysocjacji elektrolitycznej, do stężenia cząsteczek niezdysocjowanych pozostających w równowadze chemicznej z jonami; wartość nie zależy od stężenia elektrolitu, jedynie od temperatury
Bibliografia
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2020.
Pac B., Zegar A., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków 2020.
Pazdro K., Chemia. Podręcznik do kształcenia rozszerzonego w liceach, Część IV. Chemia nieorganiczna, Warszawa 2009.