Przeczytaj
Czym są aminy aromatyczne?

Najprostszą aminą aromatyczną jest fenyloamina, powszechnie zwana aniliną. Związek ten jest oleistą, bezbarwną cieczą o charakterystycznym zapachu zepsutych ryb, która na powietrzu brunatnieje. Zmiana barwy aniliny związana jest z jej utlenieniem utlenieniem przez tlen atmosferyczny, czego wynikiem są barwne zanieczyszczenia. Anilina słabo rozpuszcza się w wodzie, ale dobrze w alkoholu, eterze i benzenie. Jest substancją toksycznąsubstancją toksyczną.
Właściwości chemiczne aniliny
Anilina i inne aminy aromatyczne wykazują słabszy charakter zasadowy niż aminy alifatyczne. Ich odczynodczyn jest prawie obojętny, a zasadowość maleje wraz ze wzrostem rzędowościrzędowości amin.
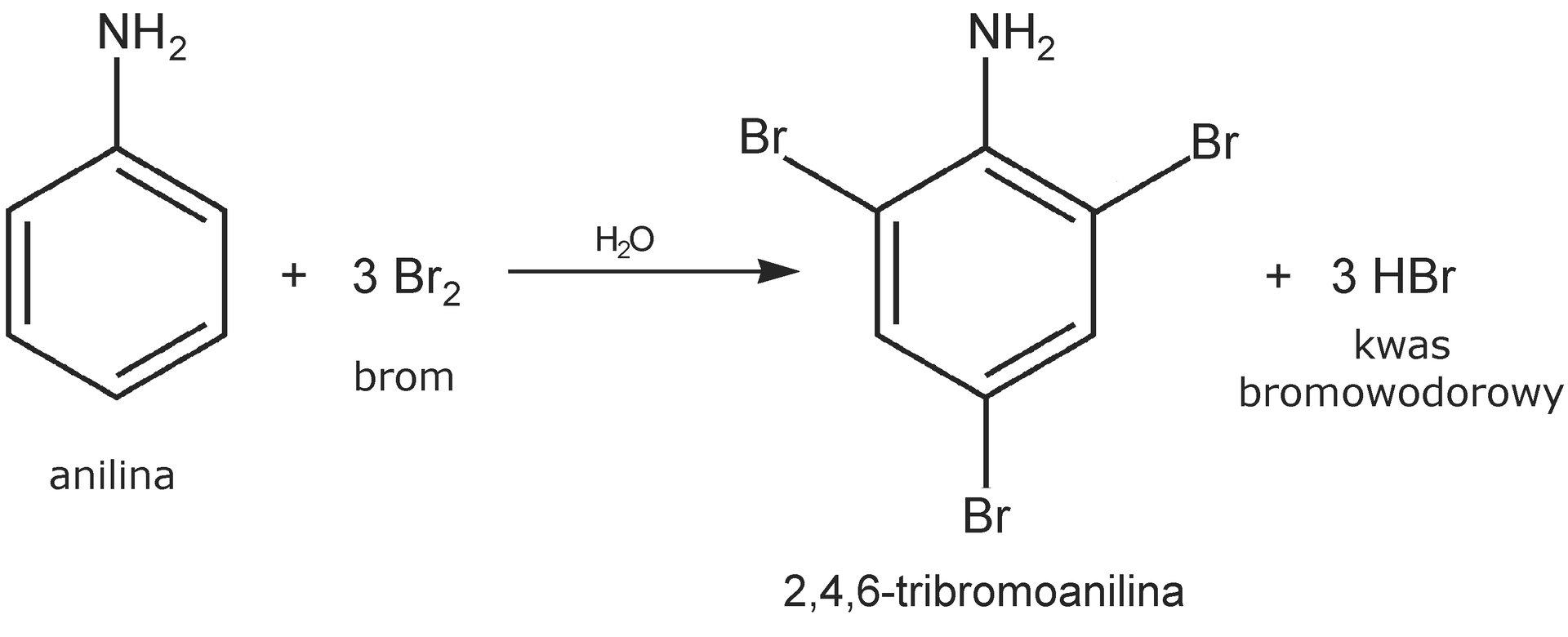
Anilina jako słaba zasada może reagować z kwasami w wyniku czego powstają sole. Obecność grupy aminowej powoduje zwiększenie reaktywności pierścienia aromatycznego podczas substytucji elektrofilowej. Anilina ulega reakcji polisubstytucji elekrofilowej.
Należy pamiętać, że grupa obecna w cząsteczce aniliny jako silnie aktywujący podstawnik pierwszego rodzaju, kieruje w reakcjach substytucji elektrofilowej następny podstawnik na pozycję orto i para, ale np. podczas nitrowania powstaje również –nitroanilina. W silnie kwaśnym środowisku reakcji następuje protonowanie grupy aminowej, która w tej formie () jest podstawnikiem drugiego rodzaju.
Nitrowanie aniliny nie jest praktyczną reakcją do otrzymania jej nitropochodnych. W silnie kwasowym środowisku, grupa aminowa przyjmuje proton, skutkuje to powstaniem jonów anilinowych . Wynikiem przeprowadzenia reakcji nitrowania aniliny są trzy izomery meta, orto oraz para, oraz wydzielenie smoły.
Otrzymywanie aniliny
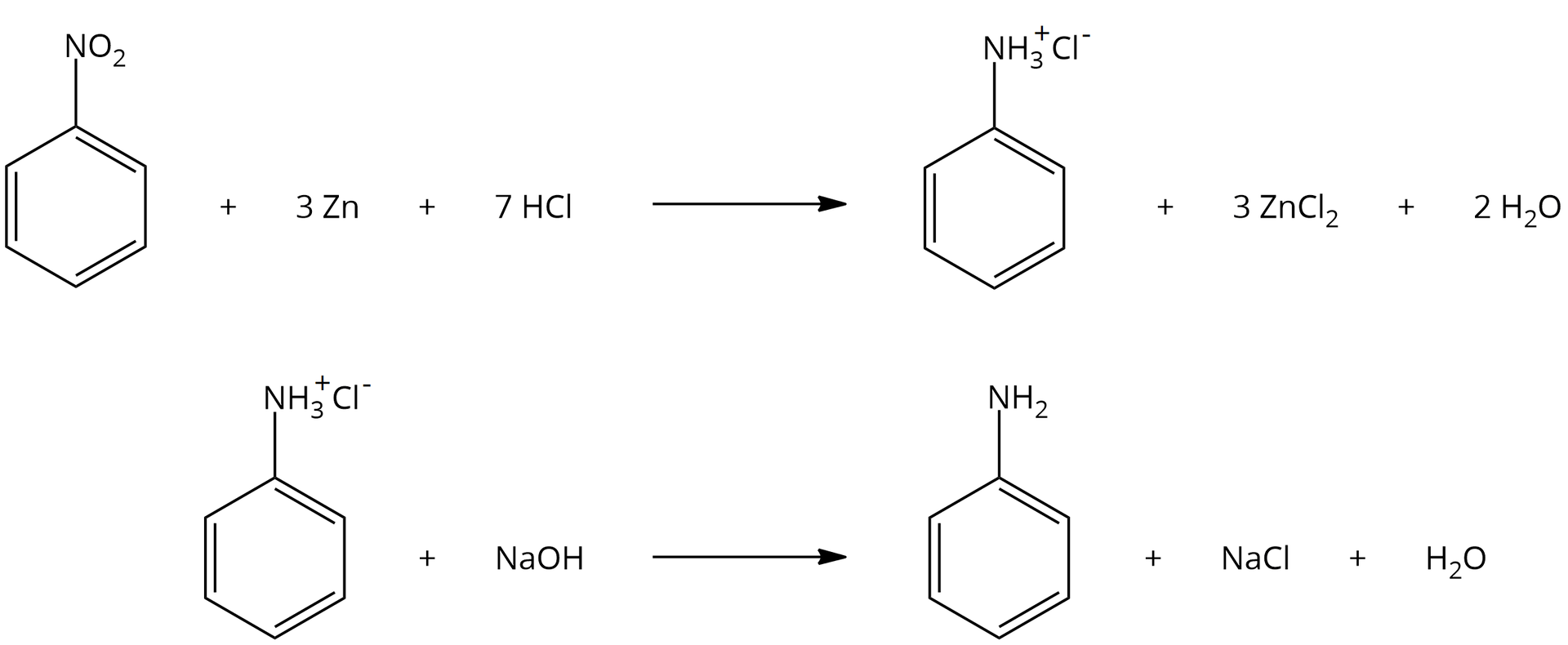
Anilina powstaje w wyniku redukcjiredukcji nitrobenzenu, którą prowadzi się wodorem atomowym in statu nascendi (w chwili tworzenia, powstawania). Ogólny zapis tego procesu przedstawia równanie:

Atomowy wodór otrzymuje się w reakcji cynku lub żelaza z kwasem solnym. Dlatego pełny zapis redukcji nitrobenzenu przeprowadzanej za pomocą np. cynku i kwasu solnego, wygląda następująco:
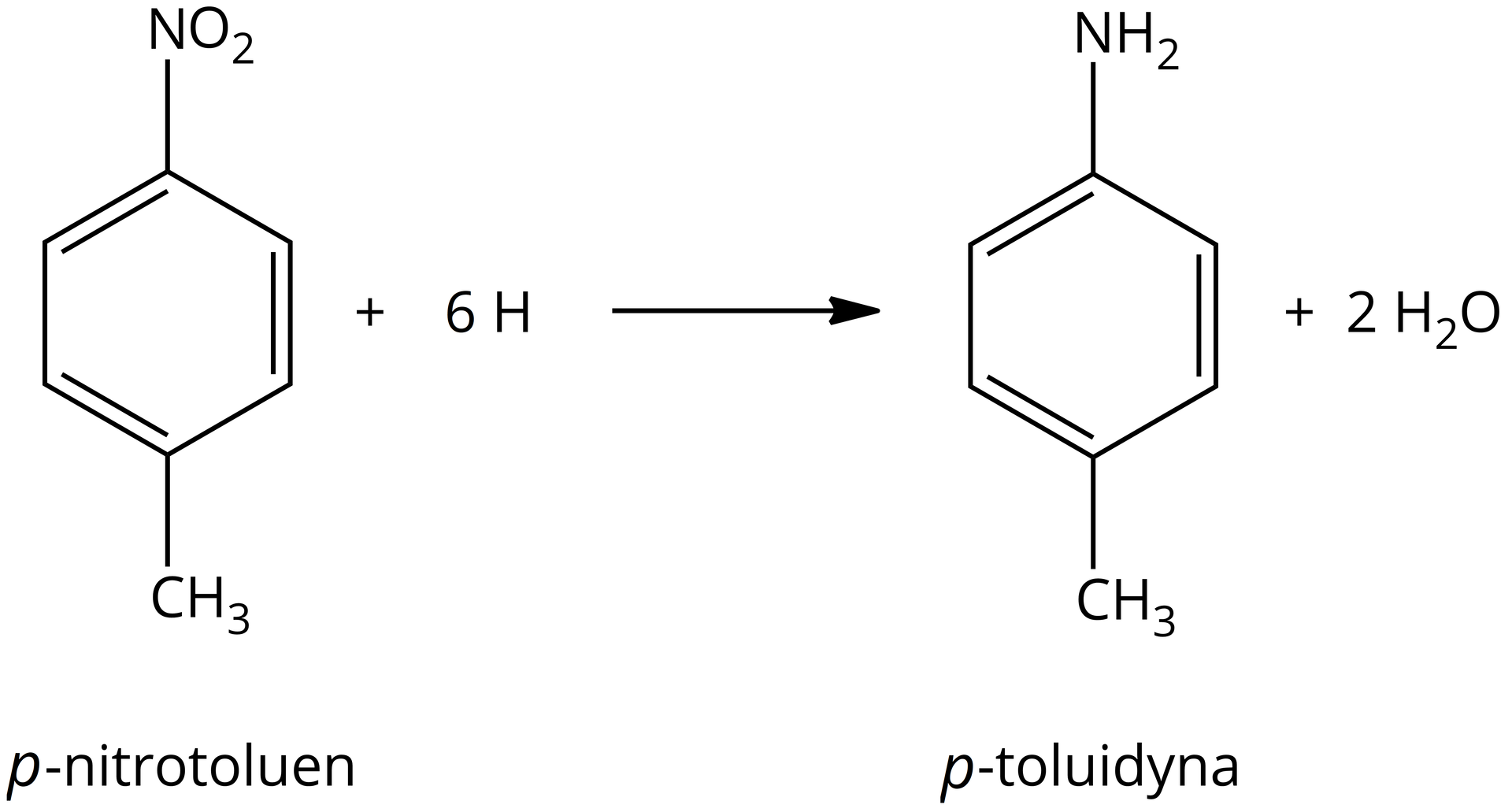
Inne aromatyczne aminy również otrzymuje się przez redukcję odpowiedniego nitrozwiązku. Dzieje się tak chociażby w przypadku otrzymywania –toluidyny.
Słownik
substancja, która wprowadzona do organizmu, powoduje zaburzenia czynności fizjologicznych (chorobę), a nawet śmierć
odczyn roztworu; cecha roztworu elektrolitu, zależna od równowagi między właściwościami kwasowymi a zasadowymi substancji rozpuszczonych w roztworze; odczyn roztworu wodnego może być kwaśny, zasadowy lub obojętny, w zależności od tego, czy przeważa stężenie (aktywność) uwodnionych jonów wodoru, często oznaczanych skrótowo symbolem , czy jonów wodorotlenkowych ; odczynowi obojętnemu odpowiadają jednakowe stężenia tych jonów, to jest
równa jest liczbie atomów wodoru przy atomie azotu, zastąpionych atomami węgla; aminy –rzędowe określone są wzorem , aminy –rzędowe wzorem , a aminy –rzędowe – ( – alkil lub aryl)
elektronacja; chemiczny proces, który polega na pobraniu elektronu (elektronów) przez jon lub atom, w wyniku czego maleje stopień utlenienia pierwiastka
zwyczajowe określenie niektórych reakcji kondensacji, prowadzących do wytworzenia wiązania węgiel–węgiel lub węgiel–heteroatom
rodzaj izomerii konstytucyjnej; związana z położeniem podstawników w pierścieniu benzenowym; izomer orto (w nazwach orto– lub –) oznacza cząsteczkę z podstawnikami w pozycjach i ; meta (meta–, –) w pozycjach i ; para (para–, –) w pozycjach i
kierują następny podstawnik w pozycje orto i para względem siebie
kierują następny podstawnik w pozycję meta względem siebie
sześć elektronów znajdujących się w układzie, połączonych i zdelokalizowanych orbitali , występującym w cyklicznych cząsteczkach aromatycznych związków organicznych
Bibliografia
Encyklopedia PWN
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko–Biała 2010.
Morrison R.T., Boyd R.T, Chemia organiczna Tom 1, PWN Warszawa 1990