Przeczytaj
Pierwiastki grupy układu okresowego
Pierwiastki grupy układu okresowego, do których należą hel (), neon (), argon (), krypton (), ksenon () oraz radon (), nazywane są gazami szlachetnymi lub helowcami. W przeciwieństwie do wielu innych pierwiastków występujących w warunkach normalnych w stanie gazowym, pierwiastki grupy układu okresowego są gazami występującymi w postaci atomowej. Helowce są pierwiastkami najmniej aktywnymi chemicznie spośród wszystkich innych pierwiastków układu okresowego – stąd właśnie wspomniana ich nazwa „gazy szlachetne”.
Można zauważyć, że w warunkach pokojowych wszystkie są gazami, co też odzwierciedla się w zwyczajowej nazwie tej grupy.
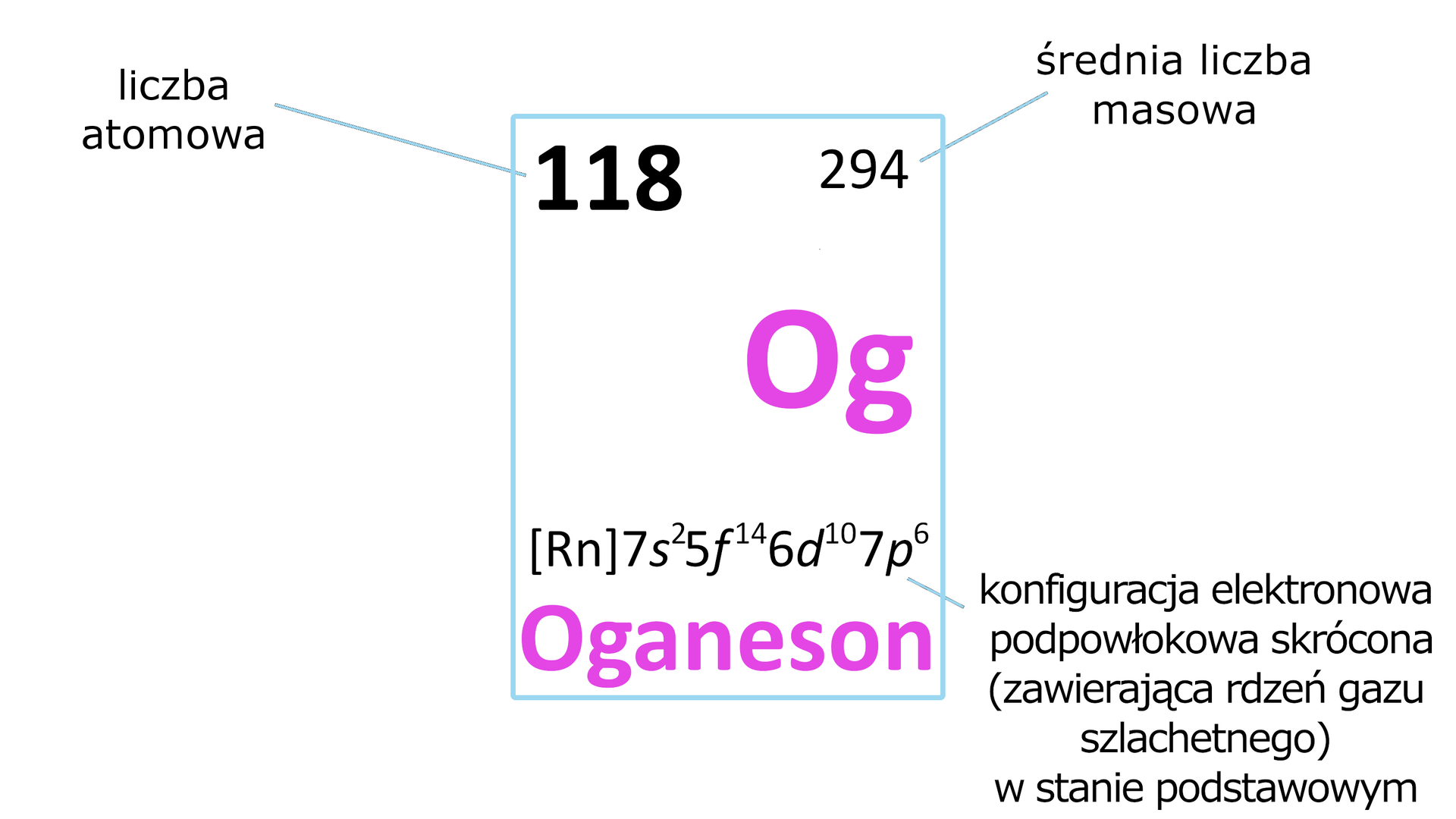
Oganeson to syntetyczny pierwiastek chemiczny o symbolu i liczbie atomowej . Po raz pierwszy został zsyntetyzowany w roku. Jego nazwa pochodzi od rosyjskiego fizyka jądrowego – Jurija Oganessiana. Radioaktywne atomy tego pierwiastka są bardzo niestabilne. Chociaż leży w grupie (gazów szlachetnych), to najprawdopodobniej w warunkach normalnych byłby ciałem stałym.
Co sprawia, że pierwiastki grupy układu okresowego niechętnie wchodzą w reakcje chemiczne lub nie reagują wcale?
Celem tworzenia wiązań chemicznych przez atomy jest osiągnięcie najkorzystniejszej konfiguracji elektronowej.
Najlżejsze pierwiastki, takie jak wodór czy lit, zwykle dążą do osiągnięcia tzw. dubletu elektronowego, czyli do konfiguracji, w której posiadają tylko dwa elektrony na podpowłoce . W przypadku wodoru, wymaga to przyjęcia lub uwspólnienia jednego elektronu z innym atomem, a w przypadku litu – oddania jednego elektronu i przekształcenia się w kation litu .
Cięższe atomy osiągają trwałe konfiguracje zwykle poprzez zapełnienie zewnętrznej powłoki elektronowej elektronami, opisanymi orbitalami typu i . Natomiast ze wzrostem liczby atomowej pojawiaja się kolejne odstępstwa i wyjątki od tej reguły. Do utworzenia wiązania chemicznego dochodzi, gdy energia powstałego związku jest niższa od sumy energii atomów tworzących dany związek. Dla przykładu: atom fluoru posiada siedem elektronów walencyjnych (), natomiast atom wodoru – tylko jeden (). W wyniku kombinacji liniowej orbitali wodoru i fluoru, powstają dwa orbitale molekularne – wiążący (, czyt. sigma) i niewiążący (). Orbital wiążący, na którym znajduje się para elektronów tworzących wiązanie, ma niższą energię niż orbitale pojedynczych atomów (wodoru i fluoru). Utworzenie takiego wiązania jest zatem korzystne energetycznie.

Jeśli zapiszesz konfiguracje elektronowe atomów pierwiastków grupy układu okresowego w stanie podstawowym, to z łatwością zauważysz, że spełniają one warunki, które kilka zdań wcześniej opisaliśmy jako warunki osiągniecia tzw. trwałej konfiguracji elektronowej. Hel bowiem posiada dwa elektrony na orbitalu , podczas gdy wszystkie pozostałe gazy szlachetne mają obsadzoną zewnętrzną powłokę elektronową – konkretnie orbitale typu i typu – elektronami. Zatem pierwiastki te nie mają potrzeby tworzenia wiązań chemicznych.
Wskazaliśmy, że podstawowym celem tworzenia wiązań jest osiągnięcie trwałej konfiguracji elektronowej, a atomy helowców osiągają opisane konfiguracje trwałe w stanie wolnym, bez tworzenia wiązań chemicznych. Potwierdzają to wysokie wartości pierwszej energii jonizacji, które dla helowców przyjmują wartości większe od , podczas gdy np. dla sodu, który chętnie oddaje elektron, energia ta przyjmuje wartość .
Konfiguracja elektronowa oraz wartość energii jonizacji pierwiastków grupy układu okresowego:
Pierwiastek | Konfiguracja elektronowa | Energia jonizacji |
Hel | ||
Neon | ||
Argon | ||
Krypton | ||
Ksenon | ||
Radon |
Indeks górny Źródło: Tabela wykonana na podstawie: Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010, s. 566. Indeks górny koniecŹródło: Tabela wykonana na podstawie: Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010, s. 566.
Nie oznacza to, że helowce w ogóle nie tworzą związków chemicznych. Reaktywność tych pierwiastków zwiększa się w dół grupy. Związane jest to ze wzrostem odległości elektronów walencyjnych od jądra. Im dalej elektron walencyjny znajduje się od jądra, tym słabiej jest z nim związany (łatwiej go oderwać). W dół grupy maleje energia jonizacji tych pierwiastków.
Pierwszym otrzymanym związkiem ksenonu był heksafluoroplatynian ksenonu – czerwonopomarańczowe ciało stałe zsyntetyzowane w roku. Powstał w wyniku reakcji heksafluorku platyny z ksenonem w temperaturze pokojowej. Atom ksenonu posiada dostatecznie niską energię jonizacji, aby mógł oddawać elektrony atomom innych pierwiastków o silnej elektroujemnościelektroujemności (np. fluorowi). Ksenon jest helowcem o największej liczbie zsyntetyzowych związków.
To odkrycie przyczyniło się do rozpoczęcia prac nad syntezą innych związków helowców.
Ksenon w specjalnych warunkach (temperatura, ciśnienie) tworzy związki z fluorem oraz z tlenem, takie jak np.:
difluorek ksenonu (fluorek ksenonu());
tetrafluorek ksenonu (fluorek ksenonu());
heksafluorek ksenonu (fluorek ksenonu()) (otrzymany pod wyższymi ciśnieniami).
Tworzy także związki z tlenem, takie jak: tritlenek ksenonu (tlenek ksenonu(), kwas ksenonowy .
Radon jest pierwiastkiem promieniotwórczym, dlatego badanie jego związków jest trudne. Znanych jest kilka jego związków, m.in. fluorki radonu: , , , tritlenek radonu .
Inne związki helowców (helu, neonu, argonu i kryptonu) również mogą istnieć jedynie w szczególnych warunkach. Na przykład fluorek kryptonu powstaje pod wysokim ciśnieniem. Innym związkiem kryptonu jest fluorowodorek kryptonu .
Słownik
miara zdolności atomu do przyciągania elektronów
minimalna energia, która jest potrzebna do oderwania elektronu od atomu danego pierwiastka w fazie gazowej
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010.
Jones L., Atkins P., Chemia ogólna: cząsteczki, materia, reakcje, tłum. J. Kuryłowicz, Warszawa 2012.
Litwin M., Styska‑Wlazło S., Szymońska J., To jest chemia 1. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2012.





