Przeczytaj
Właściwości redukujące
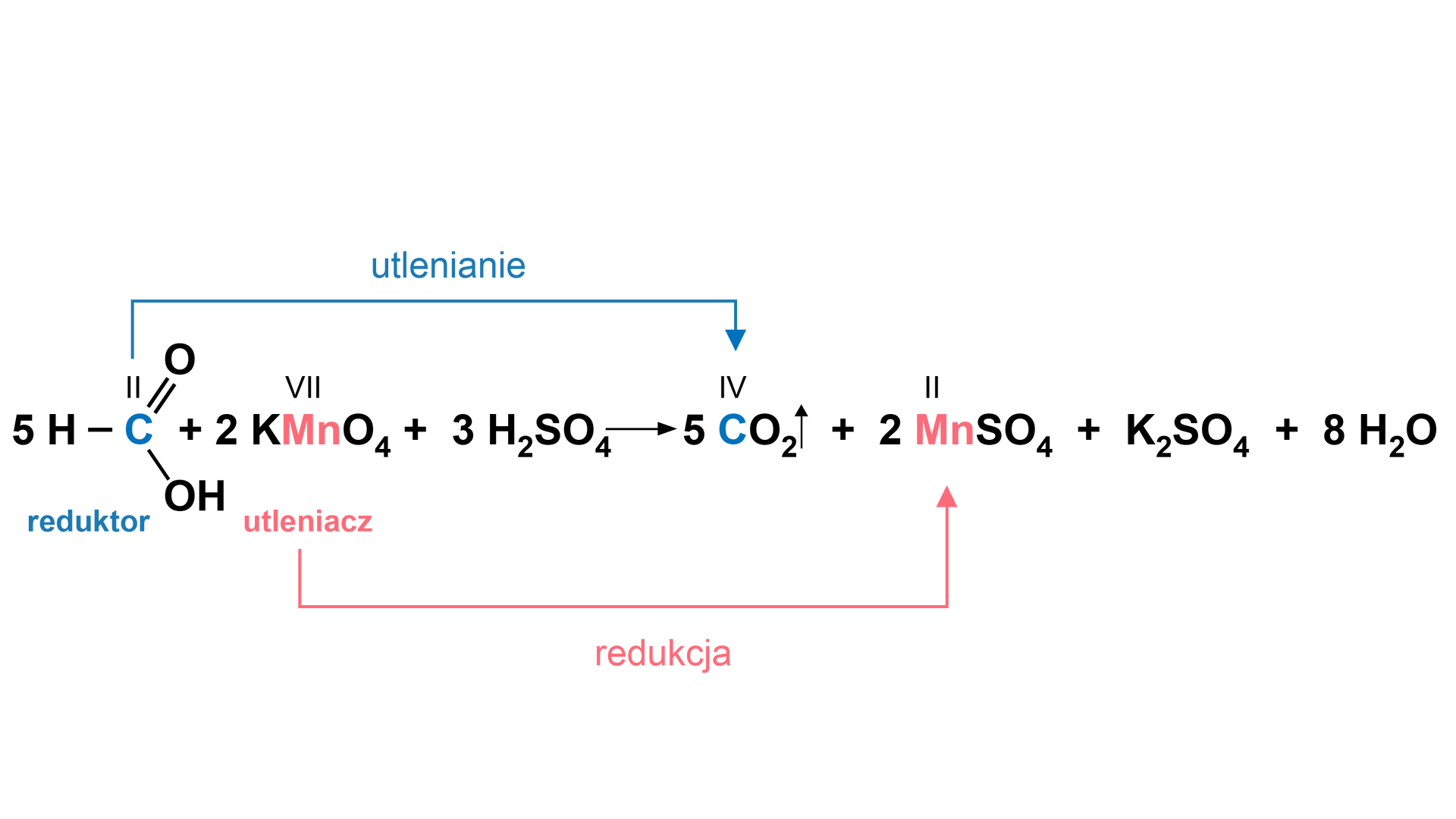
Właściwości redukujące posiada ta substancja, którą określa się mianem reduktorareduktora. Redukuje ona inną substancję, sama się utleniając. Reduktor oddaje elektrony, przez co podwyższa swój stopień utlenieniastopień utlenienia. Takie właściwości posiada kwas mrówkowy (metanowy), jedyny z kwasów karboksylowych.

Dlaczego kwas mrówkowy (metanowy) posiada właściwości redukujące?
W cząsteczce kwasu mrówkowego (metanowego), oprócz grupy karboksylowej, występuje również grupa aldehydowa.
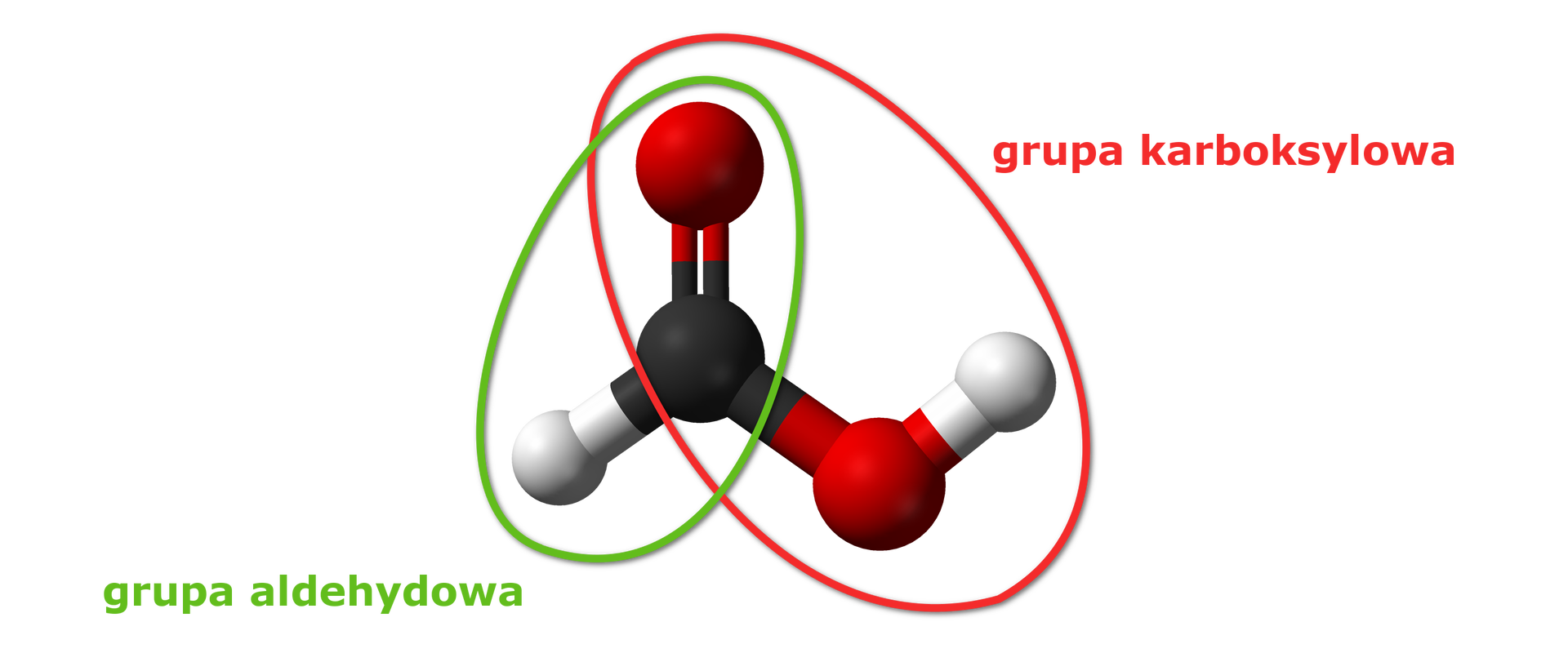
W przeciwieństwie do pozostałych kwasów karboksylowych w szeregu homologicznym kwas mrówkowy posiada atom wodoru przyłączony bezpośrednio do grupy karboksylowej. Konsekwencją takiej budowy kwasu mrówkowego jest możliwość pełnienia roli reduktora w reakcjach chemicznych. Za właściwości redukujące kwasu mrówkowego odpowiada grupa aldehydowa.
Badanie właściwości redukujących kwasu mrówkowego (metanowego)
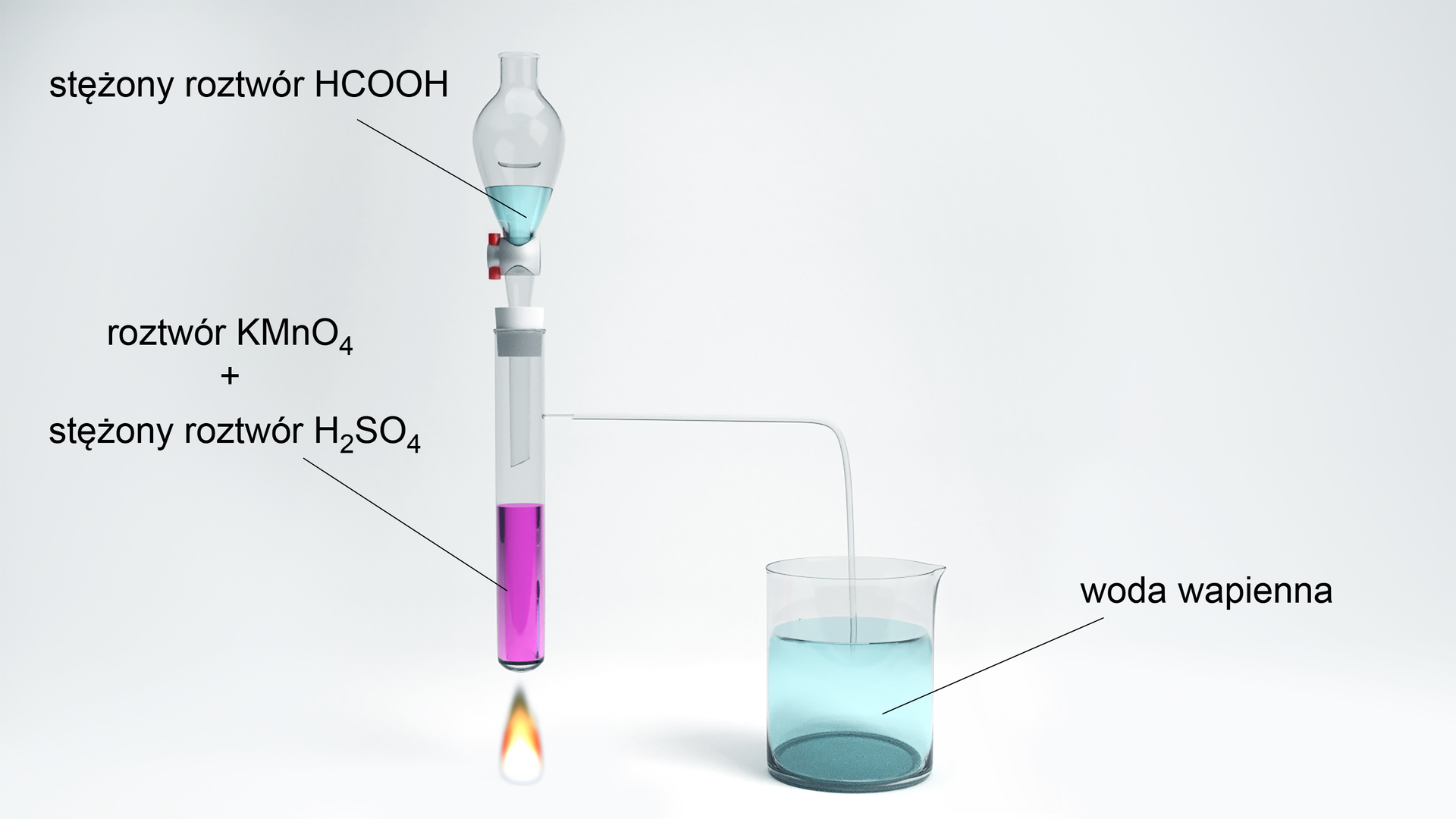
Doświadczenie I
Schemat doświadczenia:
Doświadczenie II
Schemat doświadczenia:
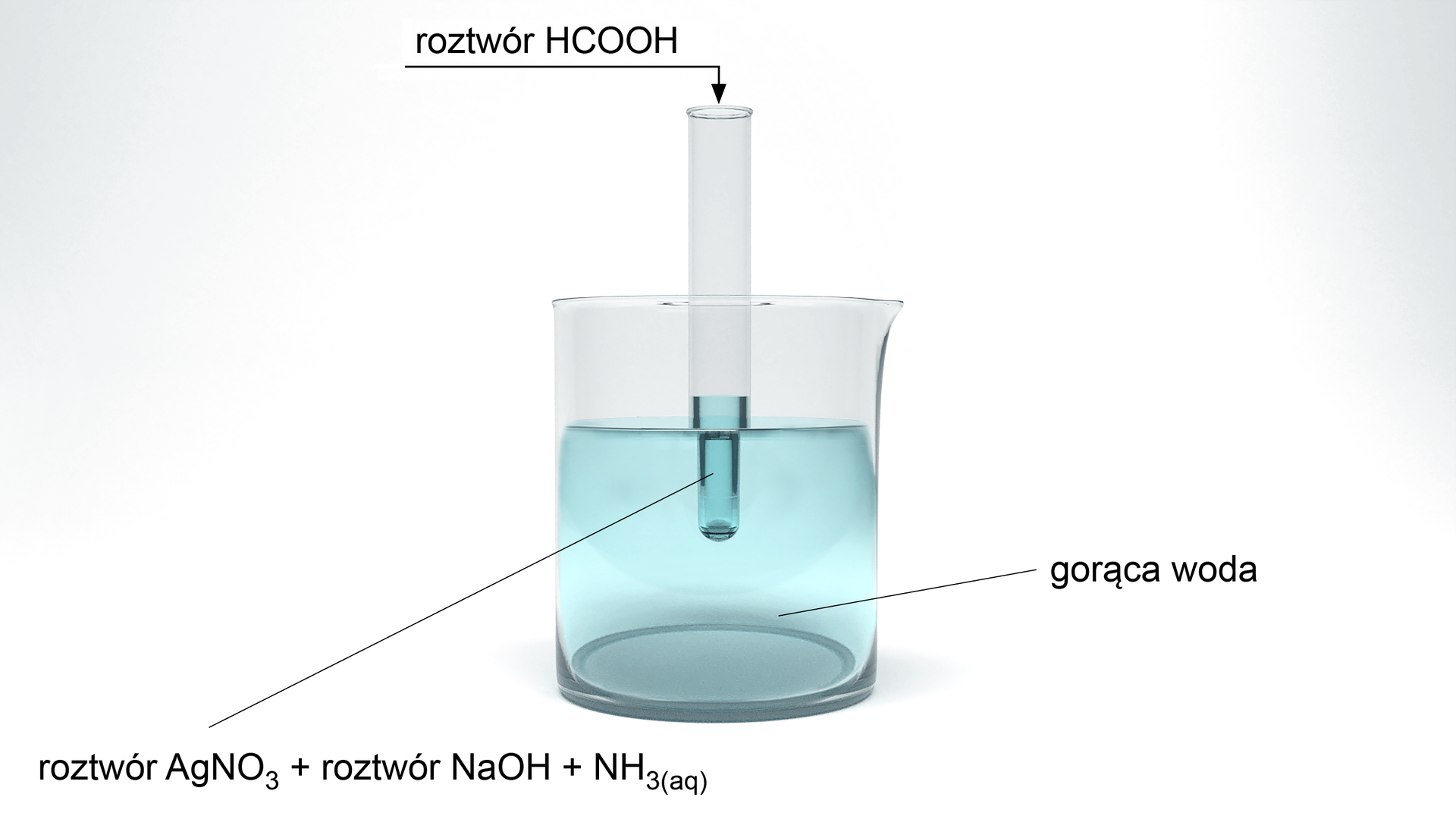
Próba Tollensa
Powyższe doświadczenie, które jest nazywane próbą Tollensa, składa się z kilku etapów, dlatego przyjrzyjmy się każdemu etapowi z osobna.
I etap
Wodorotlenek sodu reaguje z azotanem(V) srebra(I). W wyniku reakcji powstaje nierozpuszczalny wodorotlenek srebra(I).
Wodorotlenek srebra(I) jest nietrwały i ulega reakcji rozkładu do tlenku srebra(I).
II etap
Tlenek srebra(I) tworzy z wodą amoniakalną związek kompleksowy wodorotleneku diaminosrebra(I). Występuje on w wodzie w formie zdysocjowanej.
III etap
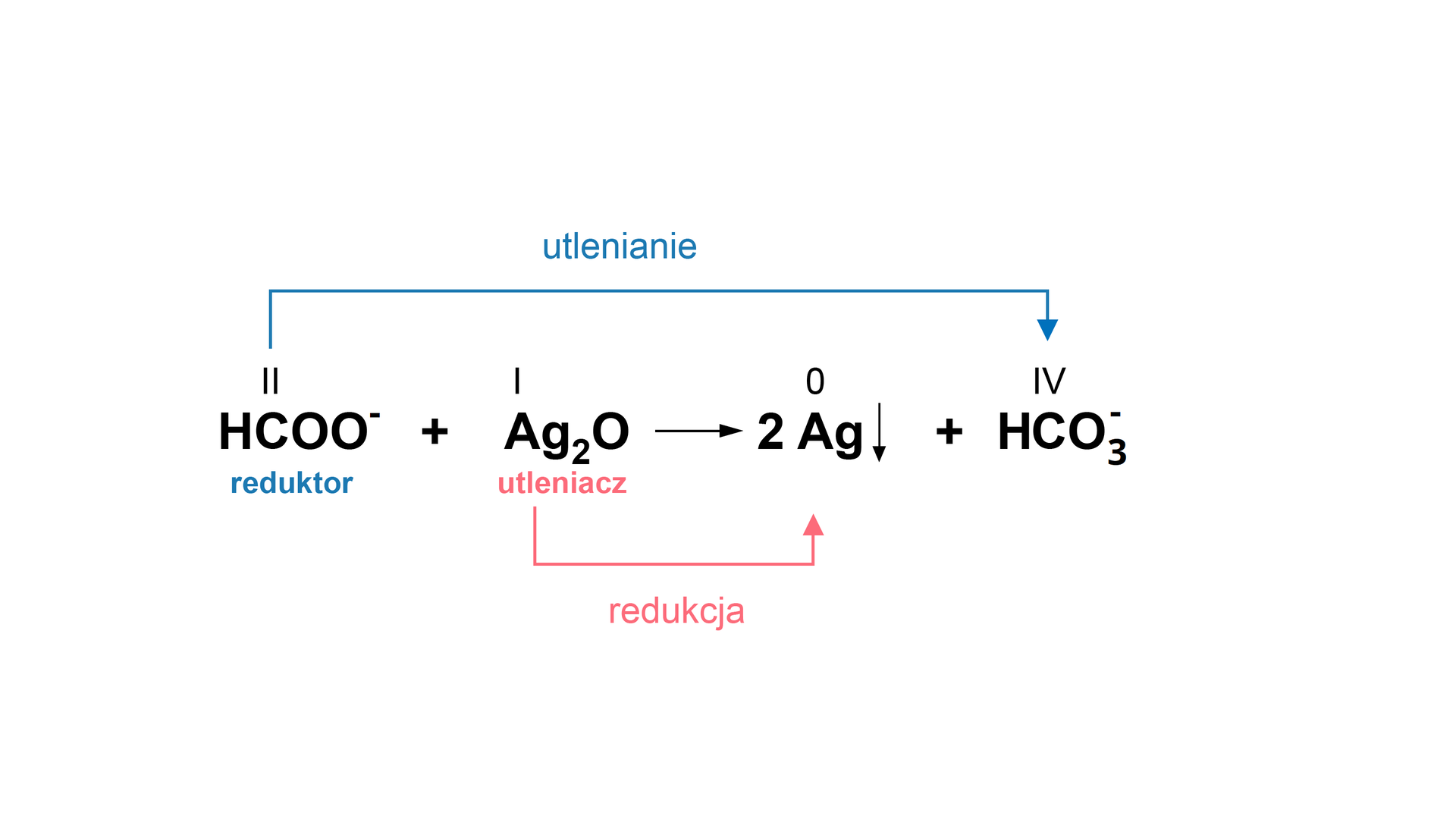
Powstały związek kompleksowy reaguje z kwasem mrówkowym (metanowym).
W rzeczywistości powyższa reakcja w etapie trzecim przebiega w kilku krokach.
Podsumowując wszystkie wymienione etapy doświadczenia, można przedstawić uproszczone równanie reakcji, w której kwas mrówkowy reaguje z tlenkiem srebra(I).
Właściwości redukujące to niejedyne właściwości, które wyróżniają kwas mrówkowy spośród kwasów karboksylowych. Charakterystyczną reakcją jest reakcja odwodnienia. Ogrzewanie kwasu mrówkowego ze stężonym kwasem siarkowym(VI) prowadzi do rozkładu związku, w wyniku czego powstaje woda i tlenek węgla(II). Reakcja jest wykorzystywana do otrzymywania tlenku węgla(II) w laboratorium.
Podsumowanie
Jako jedyny spośród kwasów karboksylowych, kwas mrówkowy posiada właściwości redukujące. Wynika to z obecności grupy aldehydowej w cząsteczce tego kwasu. Dowodem na właściwości kwasu mrówkowego jest pozytywny wynik próby Tollensa oraz doświadczenie z roztworem manganianu(VII) potasu w środowisku kwasowym.
Słownik
substancja posiadająca właściwości redukujące – redukuje inną substancję, sama się utleniając. Reduktor oddaje elektrony, przez co podwyższa swój stopień utlenienia
liczba ładunku elementarnego, jaki posiadałby atom, gdyby w danej substancji wszystkie wiązania były jonowe
klarowny nasycony roztwór wodorotlenku wapnia
substancja, która utlenia inną substancję, sama się redukując. Utleniacz przyjmuje elektrony, przez co obniża swój stopień utlenienia
reakcja polegająca na oddawaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest podwyższenie ich stopnia utlenienia
reakcja polegająca na przyjmowaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest obniżenie ich stopnia utleniania
związek chemiczny, którego cząsteczka składa się atomu lub jonu tzw. centralnego, połączonego za pomocą wiązań koordynacyjnych z ligandami. Może być nim jon lub cząsteczka obojętna
Bibliografia
Bobrański B., Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M, Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska- Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2003.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
Litwin M., Styka – Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
McMurry J., Chemia organiczna 4, Warszawa 2004.
McMurry J., Chemia organiczna 3, Warszawa 2003.
Pazdro K. M., Rola – Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.