Przeczytaj
Co to jest kinetyka chemiczna?
Kinetyka chemiczna to dział, który pozwala przeanalizować reakcję chemiczną i poznać szczegóły jej przebiegu w zależności od wielu różnych czynników. Co ważne, kinetyka chemiczna zajmuje się również badaniem szybkości reakcji chemicznych. Dzięki temu można odpowiedzieć na pytanie, w jaki sposób substraty przekształcają się w zupełnie inne produkty. Zgodnie z kluczową teorią zderzeń, mogą one przereagować wyłącznie wtedy, gdy zderzą się ze sobą, a wytworzona energia będzie odpowiednio wysoka. Wówczas to wysokoenergetyczne zderzenie nazywane jest zderzeniem efektywnymzderzeniem efektywnym, a energia, jaką muszą mieć reagenty, nazywana jest energią aktywacji.energią aktywacji. W trakcie zderzenia efektywnego powstaje kompleks aktywnykompleks aktywny, który jest nietrwałym stanem przejściowym na drodze od substratów do produktów. Ten stan przejściowy charakteryzuje się częściowymi zmianami wiązań i przegrupowaniami, posiada również wysoką energię wewnętrzną. Energia ta jest wyższa od tej dla sumy substratów przed zderzeniem efektywnym.
gdzie:
i – substraty;
– kompleks aktywny;
– produkt.
![Ilustracja przedstawia dwa wykresy - reakcji egzoenergetycznej i endoenergetycznej. Wykresy zależności energii, kompleksu aktywnego [ A B ] ∗ na osi Y od czasu oś X. Reakcja egzoenergetyczna - od punktu na osi Y znajdującego się w połowie osi Y i oznaczonego jako A dodać B (energia substratów) biegnie krzywa - najpierw jest równoległa do osi X, po czym biegnie w górę i opada poniżej poziomu linii A dodać B, następnie przechodzi w krzywą równoległą do osi X oznaczoną literą C – energia produktów. W miejscu, gdzie krzywa osiąga maksimum, znajdują się dwie duże fioletowe kulki i dwie czerwone przyłączone do fioletowych - to kompleks aktywny. Tam, gdzie krzywa wznosi się kulki fioletowe są oddzielone od czerwonych. Tam, gdzie krzywa opada każda fioletowa kulka połączona jest z czerwoną kulką. Część krzywej, która znajduje się nad poziomem linii A dodać B, to energia aktywacji E indeks dolny a. Na krzywej biegnącej poniżej poziomu linii A dodać B zaznaczono ciepło reakcji delta H mniejsze od zera. Wykres reakcji endoenergetycznej. Od punktu na osi Y znajdującego się w około jednej piątej wysokości osi Y oznaczonego jako A dodać B (energia substratów) biegnie krzywa - najpierw jest równoległa do osi X, po czym biegnie w górę i opada powyżej poziomu linii A dodać B – w połowie wysokości osi Y, następnie przechodzi w krzywą równoległą do osi X oznaczoną literą C – energia produktów. W miejscu, gdzie krzywa osiąga maksimum, znajdują się dwie duże fioletowe kulki i dwie czerwone przyłączone do fioletowych - to kompleks aktywny. Tam, gdzie krzywa wznosi się kulki fioletowe są oddzielone od czerwonych. Tam, gdzie krzywa opada każda fioletowa kulka połączona jest z czerwoną kulką. Wysokość krzywej od poziomu A dodać B do maksimum to energia aktywacji E indeks dolny a. Przy krzywej znajdującej się pomiędzy A dodać B i częścią krzywej oznaczonej jako C zaznaczono ciepło reakcji delta H większe od zera.](https://static.zpe.gov.pl/portal/f/res-minimized/RxDqylkJBYMsL/1618988258/2c4g7pFUCzLEEk4t0dmPBVc3ji8dqqSN.png)
Na powyższym wykresie, w sposób obrazowy można zauważyć energię aktywacji i jej korelacje w stosunku do energii substratów (przed zderzeniem efektywnym) oraz produktów, jak i do położenia kompleksu aktywnego. Przez energię wewnętrznąenergię wewnętrzną należy rozumieć taką, która wynika z wszelkich oddziaływań, drgań, ruchów cząsteczek, elektronów i jąder w substratach oraz produktach. Analizując wykres zależności zmian energii wewnętrznej od czasu, można wyciągnąć wniosek, że początkowa energia substratów (, ) nie jest wystarczająca do zajścia reakcji, dopiero czynnik dodatkowy (np. zwiększenie temperatury) pozwala na przeprowadzenie reakcji chemicznej i osiągnięcie niezbędnej do tego celu energii aktywacji. Zatem energia aktywacji decyduje o powodzeniu danej reakcji i o jej szybkości. Czynnikami pozwalającymi na pokonanie „bariery energetycznej”, wynikającej z energii aktywacji, są:
zwiększenie stężeń substratów;
rozdrobnienie substratów;
zmianę ciśnienia (dla gazów);
mieszanie;
odpowiedni rozpuszczalnik;
zastosowanie wyższej temperatury;
dodanie katalizatora.
Równanie Arrheniusa a energia aktywacji
Ilościową zależność między stałą szybkości a temperaturą opisuje równanie Arrheniusa.
– stała gazowa wynosząca ;
– temperatura bezwzględna ();
– czynnik przedwykładniczy (czynnik częstości);
– energia aktywacji.
Równanie to pokazuje, że z im większa jest energia aktywacji, tym mocniej stała szybkości jest zależna od temperatury. Na tej podstawie można obliczyć energię aktywacji dla danej reakcji – wystarczy znać wartości stałych szybkości reakcji w dwóch różnych temperaturach ( i ). Przydatny do tego jest poniższy wzór:
Interpretacja Arrheniusa potwierdza, że reagują ze sobą tylko cząsteczki o dostatecznie wysokiej energii – chodzi tu o energię aktywacji. Wyznaczenie energii aktywacji z dwóch wartości stałych szybkości reakcji jest dopuszczalne tylko dla reakcji elementarnychreakcji elementarnych i tylko wtedy wyznaczona wartość ma sens fizyczny.
Czym jest katalizator i jak wpływa na energię aktywacji?
KatalizatorKatalizator jest substancją, która, dodana do reakcji chemicznej, przyspiesza ją, zmniejszając tym samym energię aktywacji. To z kolei ułatwia przeprowadzenie reakcji, ponieważ, łącząc się z substratami, tworzy zmodyfikowany kompleks aktywny, do którego powstania potrzebna jest znacznie mniejsza energia, niż energia tworzenia kompleksu aktywnego między substratami. Inaczej mówiąc, katalizator obniża energię aktywacji danej reakcji chemicznej. Po jej zakończeniu katalizator całkowicie się odtwarza, a więc jego ilość jest taka sama na początku, jak i na końcu. Czasami działanie katalizatora skutkuje ciągiem kilku reakcji z jego udziałem, wówczas energia aktywacji ulega zmianie na dwie lub więcej mniejszych energii aktywacji. Zjawisko przyspieszenia reakcji chemicznej przez katalizator nazywa się katalizą. Przeciwieństwem katalizatorów są inhibitoryinhibitory, które stosuje się do reakcji przebiegających zbyt gwałtownie, aby zwolnić ich przebieg i uzyskać nad nimi kontrolę. Wyróżniamy katalizatory/inhibitory homogeniczne, czyli będące w takiej samej fazie co substraty, oraz heterogeniczne, które są w innej fazie niż substraty.

Czym są reakcje endoenergetyczne i egzoenergetyczne?
Nie zawsze energia wewnętrzna substratów jest wyższa od tej, jaką posiadają produkty. Istnieją reakcje chemiczne, których przebieg związany jest z wydzieleniem energii z układu reakcyjnego (w postaci np. ciepła, światła) – mówimy wtedy o reakcjach egzoenergetycznychreakcjach egzoenergetycznych (w tym przypadku energia wewnętrzna substratów jest wyższa od energii wewnętrznej produktów). Natomiast reakcje, których produkty mają wyższą energię wewnętrzną od substratów, nazywamy reakcjami endoenergetycznymireakcjami endoenergetycznymi – dla nich wymagane jest dostarczenie energii do układu reakcyjnego.
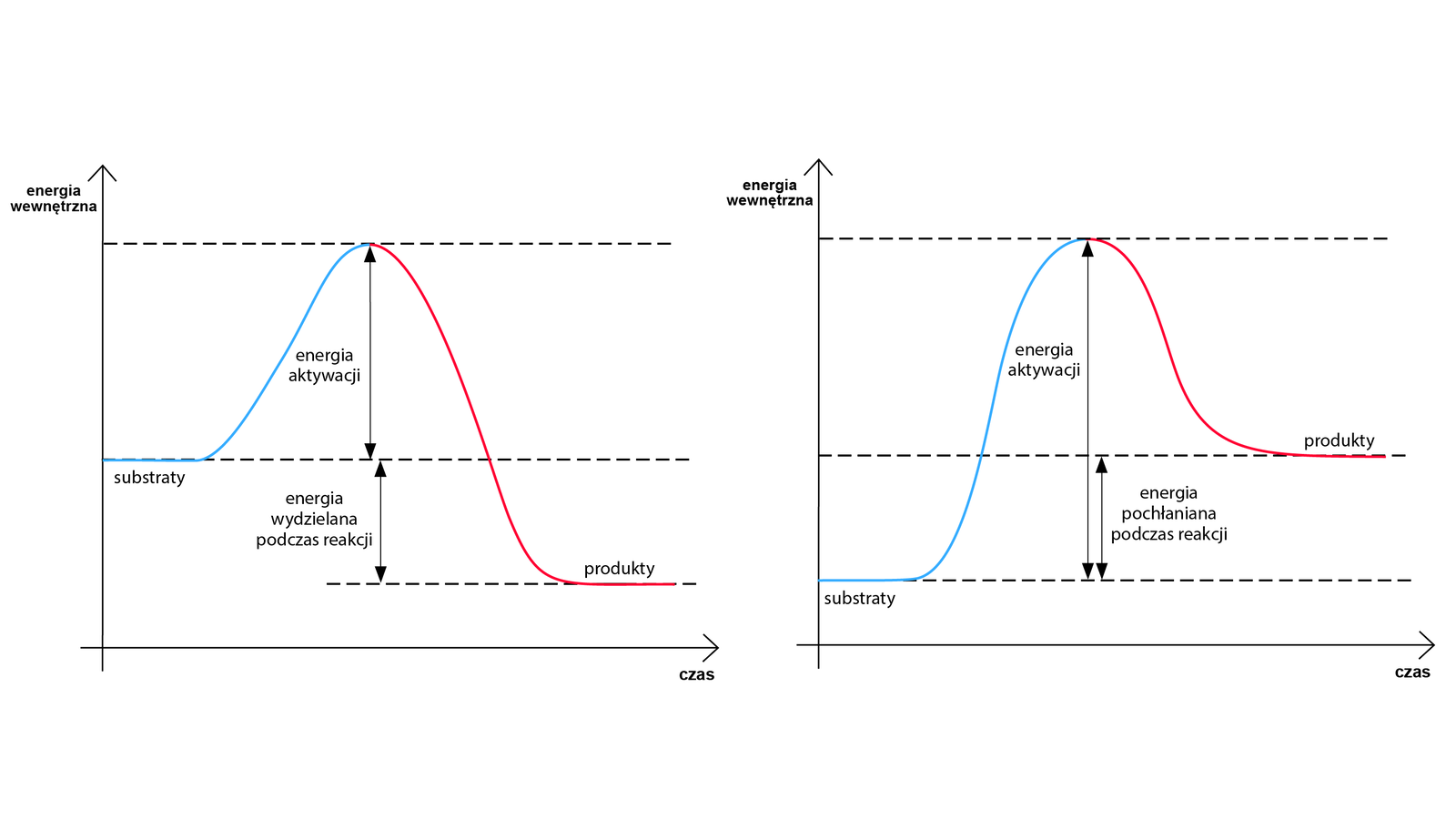
a) egzoenergetycznej
b) endoenergetycznej
Dla tych reakcji chemicznych wykres zależności zmian energii wewnętrznej od czasu się różni. Przyjmując, że zmiana energii wewnętrznej to różnica energii końcowej (produktów) z energią początkową (substratów), odczytujemy, że zmiana energii wewnętrznej dla reakcji egzoenergetycznej ma wartość ujemną, a dla reakcji endoenergetycznej dodatnią. Energia, jaka jest dostarczana lub wydzielana z układu reakcyjnego, najczęściej ma postać ciepła. Jeśli zmierzy się taką energię (pod stałym ciśnieniem), to jest to tzw. zmiana entalpii reakcji (). Przykładem reakcji egzotermicznej (podczas tej reakcji wydzielane jest ciepło) jest:
Przykładem reakcji endoenergetycznej (do przeprowadzenia tej reakcji niezbędna jest wysoka temperatura – ) jest:
Słownik
substancja chemiczna, której dodatek do reakcji powoduje przyśpieszenie reakcji chemicznej; po zakończeniu reakcji jest w całości odzyskiwana; wyróżniamy katalizatory homogeniczne, czyli będące w takiej samej fazie co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
substancja chemiczna, której dodatek do reakcji powoduje spowolnienie lub zatrzymanie reakcji chemicznej; po zakończeniu reakcji jest w całości odzyskiwana; wyróżniamy inhibitory homogeniczne, czyli będące w takiej samej fazie co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
energia, która wynika z ruchów i oddziaływań cząsteczek oraz zawartych w nich elektronów i jąder
reakcja chemiczna, która przebiega z wydzieleniem energii z układu reakcyjnego do otoczenia
reakcja chemiczna, która przebiega z pochłanianiem energii z otoczenia do układu reakcyjnego
ciepło pochłaniane lub wydzielane w czasie reakcji chemicznej, które zostało zmierzone w stałych warunkach ciśnienia i temperatury w stosunku do 1 mola reagentów
zderzenie następujące z dostatecznie dużą energią, zwaną energią aktywacji, aby mógł powstać kompleks aktywny
najmniejsza ilość energii, jaką muszą pobrać cząsteczki substratów do utworzenia kompleksu aktywnego
takie ułożenie atomów/cząsteczek substratów, które pozwala na osiągnięcie maksymalnej energii
reakcja chemiczna, która zachodzi w jednym akcie, bez produktów pośrednich, w procesie, w którym występuje tylko jeden stan przejściowy
Bibliografia
Bełtowska‑Brzezinska M., Podstawy kinetyki chemicznej. Skrypt do wykładów, Poznań 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Burewicz A., Jagodziński P., Pracownia chemiczna z dydaktyki chemii. Doświadczenia chemiczne dla szkół ponadgimnazjalnych, Poznań 2004, online: http://www.wbc.poznan.pl/Content/6711/Skrypt_liceum_1.pdf, dostęp: 25.01.2021.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.