Przeczytaj
Jakie wyróżniamy oddziaływania międzycząsteczkowe?
Pomiędzy indywiduami chemicznymi występują nie tylko wiązania chemiczne, ale także oddziaływania międzycząsteczkowe. Zostały przedstawione na poniżej zamieszczonych fiszkach.
Czym są siły van der Waalsa?

Siły van der WaalsaSiły van der Waalsa to bardzo słabe oddziaływania międzycząsteczkoweoddziaływania międzycząsteczkowe. Swoją nazwę zawdzięczają holenderskiemu fizykowi Johannesowi van der Waalsowi [johanesowi wan der walsowi], który w 1873 r. po raz pierwszy je opisał. Siły van der Waalsa występują albo pomiędzy dwoma cząsteczkami, z których jedna jest polarna (jest dipolem), albo pomiędzy dwiema niepolarnymi cząsteczkami typu czy , albo pomiędzy niewiążącymi się atomami gazów szlachetnych, albo także pomiędzy dipolami. Są to siły o charakterze oddziaływań elektrostatycznych. Nie są kierunkowe. Działają tylko na bardzo krótki zasięg. Oddziaływanie jest tym większe, im cząsteczki zbliżają się do siebie.
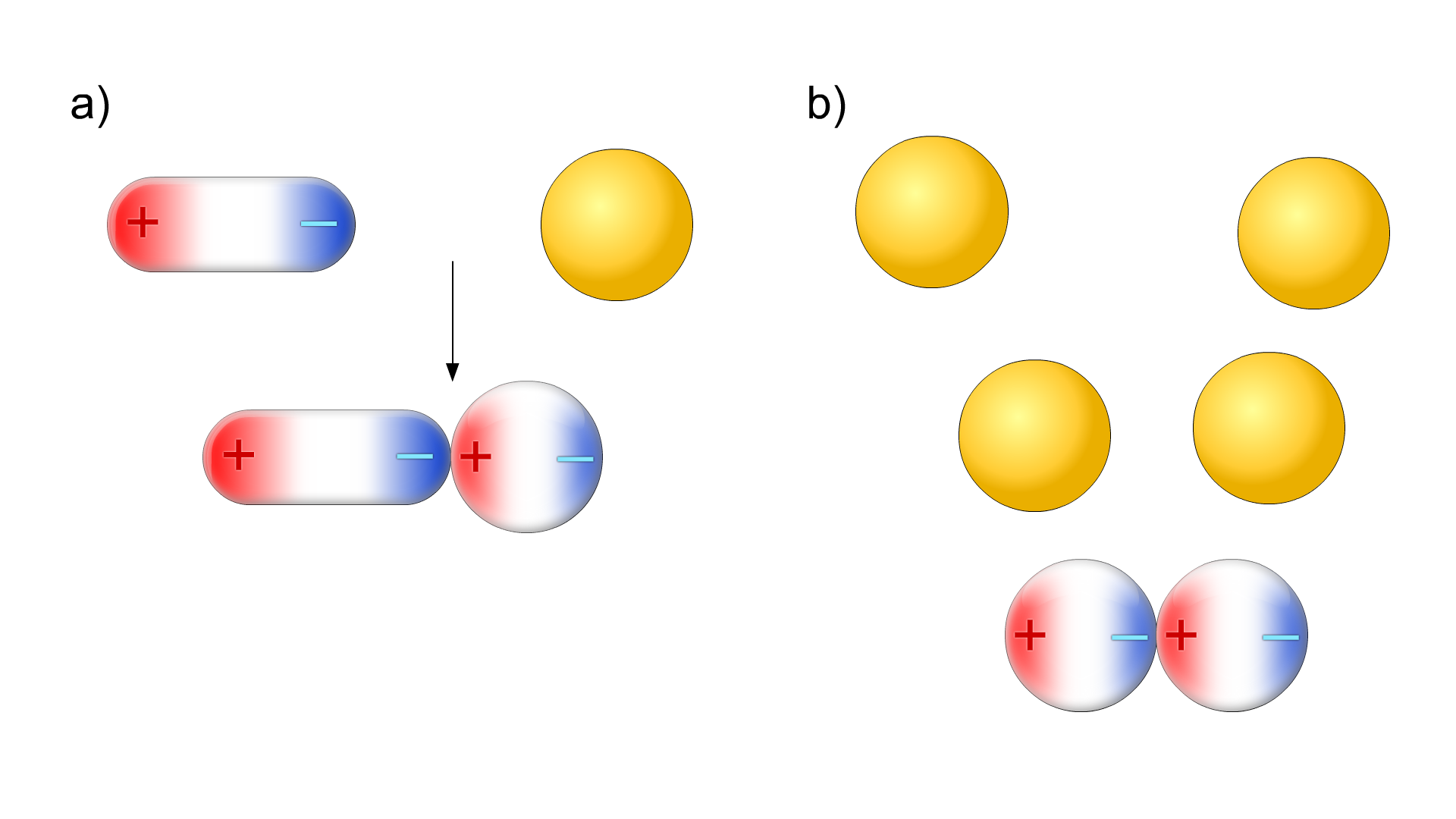
a) dipol-cząsteczka niepolarna
b) cząsteczka niepolarna-cząsteczka niepolarna
Oddziaływania van der Waalsa polegają na słabym oddziaływaniu ze sobą chmury elektronowej indywiduum chemicznego, a więc na przyciąganiu się szybkozmiennych dipoli. Kiedy elektrony walencyjne poruszają się, gęstość ładunku ujemnego na zewnętrznej powłoce atomów ulega szybkim fluktuacjom, co wzbudza również fluktuację w powłoce walencyjnej sąsiednich atomów. W wyniku tego powstają szybkozmienne dipole, które przyciągają się wzajemnie, co zwiększa wzajemną polaryzację elektronową.
Do oddziaływań van der Waalsa można zaliczyć:
przyciąganie trwałych dipoli;
przyciąganie dipola trwałego i indukowanego;
przyciąganie dipola chwilowego i indukowanego.
Za co odpowiadają siły van der Waalsa?
Siły van der Waalsa decydują o wielu istotnych zjawiskach w przyrodzie, takich jak: solwatacja, struktura cieczy i ciał stałych, właściwości gazów rzeczywistych, stan skupienia materii oraz innych. Pełnią bardzo ważną rolę w makromolekułach – np. w polimerach warunkują właściwości polimerów (czyli to, czy cząsteczka polimeru jest giętka, czy sztywna, zależy nie tylko od właściwości makrocząsteczki). Siły van der Waalsa odpowiadają również za występowanie tzw. pochłaniania powierzchniowegopochłaniania powierzchniowego, inaczej mówiąc, adsorpcji cząsteczek, czyli odkładania cząsteczek jednej substancji na powierzchni drugiej.

Siły van der Waalsa zależą również od kształtu cząsteczki. Powoduje to różnice w temperaturach wrzenia np. dla związków organicznych. Cząsteczka o wzorze może mieć strukturę liniową lub rozgałęzioną. W zależności od struktury, ma różne temperatury wrzenia. Substancja zbudowana tylko z cząsteczek liniowych ma wyższą temperaturę wrzenia, niż ta zbudowana z cząsteczek rozgałęzionych. Jest to spowodowane tym, że oddziaływania van der Waalsa są silniejsze dla bardziej zbliżonych do siebie cząsteczek o strukturze liniowej. Poniżej przedstawiono przykłady dwóch izomerów związku o wzorze ogólnym wraz z ich temperaturami wrzenia.
Mimo że są to stosunkowo słabe oddziaływania dla małych cząsteczek (kilkanaście razy słabsze od sił wiązania atomów w cząsteczce), to niekiedy mogą przewyższać siłę wiązania chemicznego. Można to zaobserwować w przypadku długołańcuchowych węglowodorów, które występują w smarach lub tworzywach sztucznych. Widać to również w temperaturach wrzenia – zazwyczaj substancje o dużej masie cząsteczkowej mają wysokie temperatury wrzenia, a substancje o małej masie cząsteczkowej – niskie. Przyczyną tego jest większa liczba elektronów w cząsteczce, czemu odpowiadają większe fluktuacje ładunków cząstkowych, uwarunkowane oscylowaniem elektronów między różnymi położeniami. Na przykład analizując atomy fluorowców, atom fluoru ma tylko dziewięć elektronów, fluktuacje w tej chmurze elektronowej są małe, a oddziaływania międzycząsteczkowe są tak słabe, że temperatura wrzenia gazowego fluoru to -188°C. W atomie bromu jest 35 elektronów, fluktuacje są częstsze, czego efektem jest zmiana temperatury wrzenia. Gazowy brom wrze w 59°C.
Ciała stałe, w których występują głównie siły van der Waalsa, charakteryzują się niższymi temperaturami topnienia i są bardziej miękkie niż te, w których występują inne oddziaływania, tj. wiązanie wodorowe.

Duża przyczepność łap gekona do powierzchni wynika nie tylko z obecności lipidów, znajdujących się na ich skórze, oraz sił elektrostatycznych, ale również występujących sił van der Waalsa. Na ich łapach znajdują się rządki mikroskopijnych włosków, dodatkowo rozszczepionych na końcach w miotełki, które są jeszcze drobniejsze. Zakończone są płaskimi nano‑szpatułkami, co powoduje zwiększenie powierzchni przylegania. Siłą odpowiedzialną za przyklejanie się włosków do powierzchni są właśnie omawiane oddziaływania. Siły van der Waalsa są tymi najsłabszymi, ale nadal odgrywają ważną rolę we właściwościach cząsteczek i w nauce o powierzchni.
Słownik
substancja chemiczna złożona z powtarzających się jednostek – merów, o bardzo dużej masie cząsteczkowej
czyli adsorpcja cząsteczek – odkładanie cząsteczek jednej substancji na powierzchni drugiej substancji
najsłabsze ze znanych oddziaływań; polegają na wzajemnym przyciąganiu się
przyciąganie występujące pomiędzy atomami sąsiadujących cząsteczek
Bibliografia
Bielański A., Podstawy Chemii Nieorganicznej, Warszawa 2010.
Penkala T., Podstawy Chemii Ogólnej, Warszawa 1982.
Wydział Nauk Medycznych i Technicznych. Semestr I: Oddziaływania międzycząsteczkowe, wiązanie metaliczne, online: http://chemia.wpt.kpswjg.pl/semestr1/temat8/temat8.html, dostęp: 01.03.2021.

