Przeczytaj
Dysocjacja elektrolityczna
Kwasy karboksylowe są słabymi elektrolitami. Kwasy karboksylowe, które rozpuszczają się w wodzie, również ulegają dysocjacji elektrolitycznej.
Nazwa kwasu | Równanie reakcji dysocjacji | |||
|---|---|---|---|---|
Kwas mrówkowy (kwas metanowy) | ||||
Kwas octowy (kwas etanowy) | ||||
Kwas benzoesowy (kwas benzokarboksylowy) | 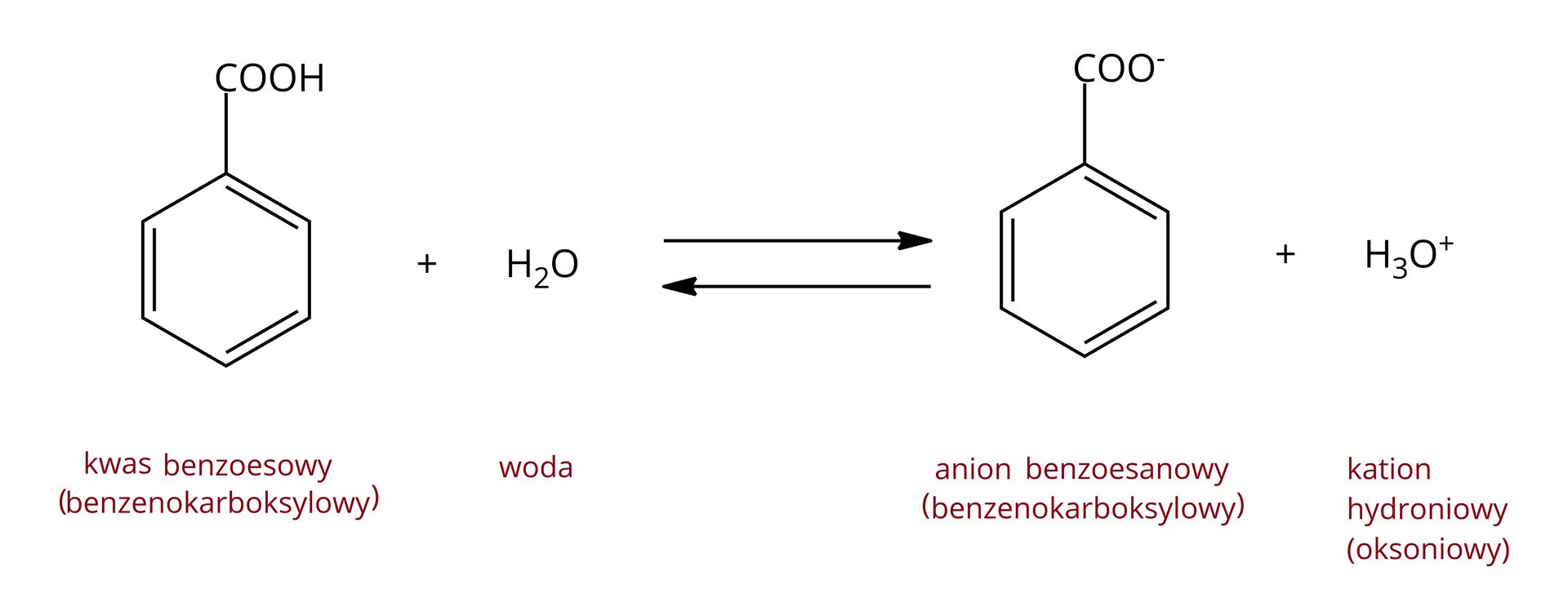 Równanie dysocjacji kwasu benzenokarboksylowego. Źródło: GroMar sp.z.o.o., licencja: CC BY-SA 3.0. | |||
Kwasy tłuszczowe nie rozpuszczają się w wodzie, a więc także nie ulegają dysocjacji elektrolitycznej.
Reakcje spalania
W zależności od dostępności tlenu, wyróżniamy kilka sposobów spalania, m.in. całkowite i niecałkowite.
Równania reakcji spalania całkowitego wybranych kwasów karboksylowych:
Równanie reakcji spalania niecałkowitego kwasu oktadekanowego (stearynowego):
Reakcja z metalami
Doświadczenie I
Reakcja z tlenkami metali
Doświadczenie II

Reakcja z wodorotlenkami metali
Doświadczenie III

W wyniku reakcji kwasu octowego (etanowego) z sodem lub tlenkiem sodu oraz wodorotlenkiem sodu otrzymujemy octan (etanian) sodu. Ta sól dobrze rozpuszcza się w wodzie. Wraz ze wzrostem temperatury wzrasta jej rozpuszczalność. Przygotowanie nasyconego roztworu tej soli, a następnie jego oziębienie, spowoduje powstanie roztworu przesyconego. Wprowadzając bagietkę lub szczyptę octanu sodu do takiego roztworu, wywołamy natychmiastową krystalizację. Powstaje ciało stałe – hydrathydrat octanu (etanianu) sodu . Procesowi towarzyszy wydzielanie ciepła, dlatego omawiana sól jest wykorzystywana w produkcji kieszonkowych ogrzewaczy termicznych.
Reakcja estryfikacji
Odwracalna reakcja pomiędzy kwasem a alkoholem, w obecności katalizatorakatalizatora (kwas siarkowy(VI) – ), to reakcja estryfikacji. W jej wyniku powstaje ester i woda. Przykładowa reakcja:
zapis cząsteczkowy
Reakcja z amoniakiem
Niektóre z kwasów karboksylowych mogą reagować z amoniakiem.
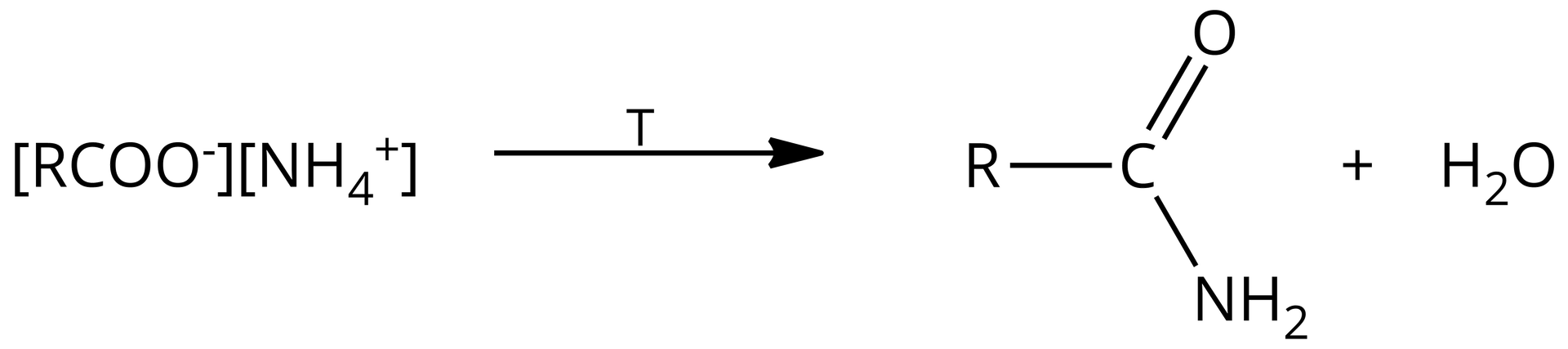
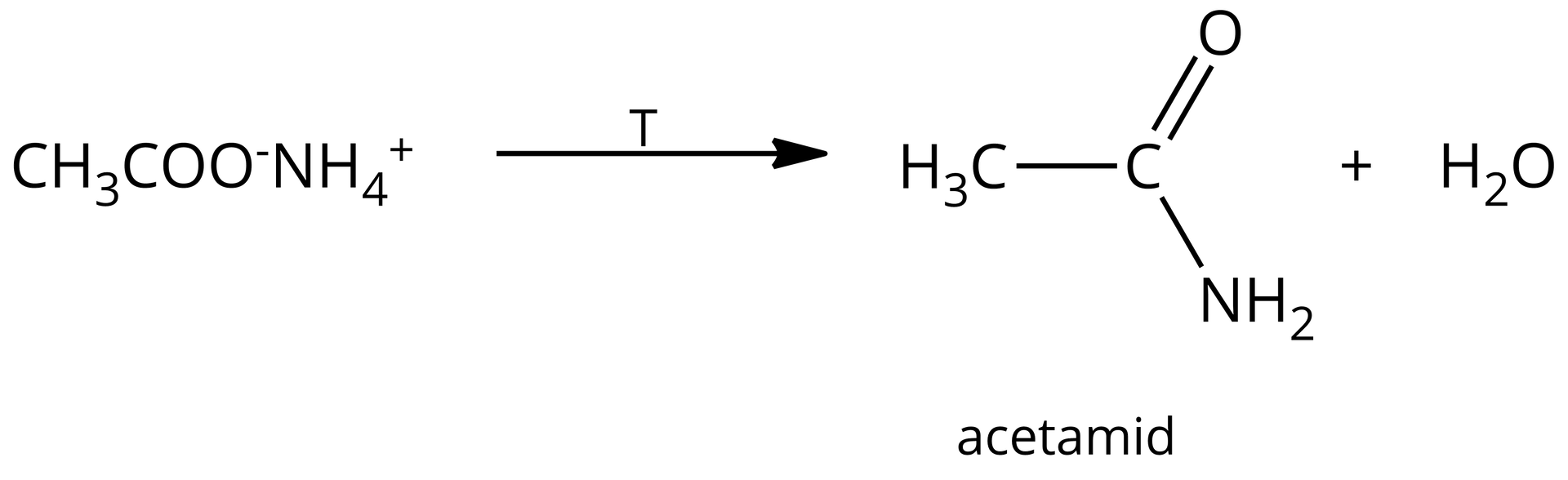
Reakcja kwasu octowego (etanowego) z amoniakiem:
Reakcja dekarboksylacji
Jest to reakcja w obrębie grupy karboksylowej, z której tworzy się tlenek węgla(IV). Powstaje w niej również węglowodór, zawierający liczbę węgli w cząsteczce o jeden mniejszą niż kwas karboksylowy, z którego powstał. Ogólny zapis reakcji dekarboksylacjireakcji dekarboksylacji kwasów karboksylowych możemy przedstawić następująco:
Reakcja redukcji
Reakcji redukcjiReakcji redukcji do odpowiednich alkoholi pierwszorzędowychalkoholi pierwszorzędowych mogą ulegać nasycone kwasy karboksylowe. W reakcji redukcji wymagane jest użycie katalizatora.
Powyższa reakcja przedstawia reakcję redukcji kwasu propanowego do propan‑1-olu. Jest to reakcja redukcji, ponieważ stopień utlenieniastopień utlenienia węgla grupy funkcyjnejgrupy funkcyjnej kwasu propanowego zostaje obniżony z III na -I.
Reakcja redukcji nasyconych kwasów tłuszczowych prowadzi do powstania alkoholi pierwszorzędowych o długich łańcuchach, które znajdują zastosowanie przy produkcji detergentów.
Równanie redukcji kwasu oktadekanowego (stearynowego):
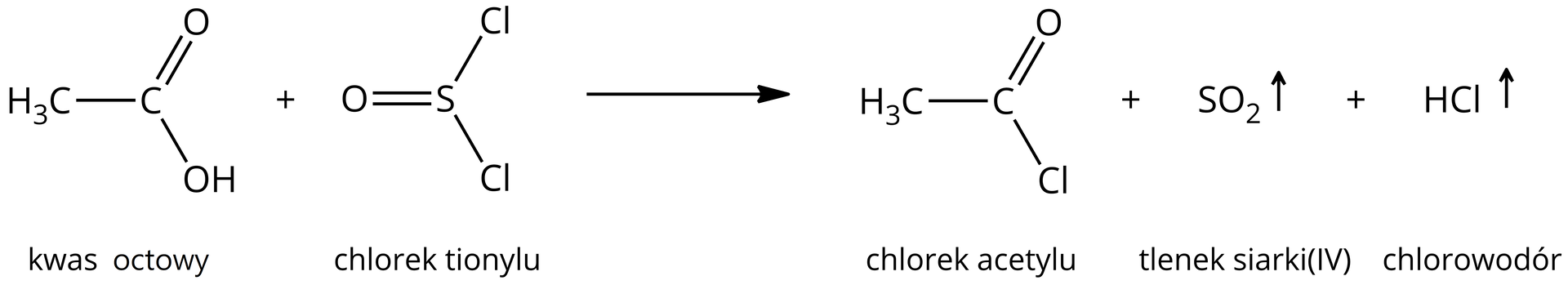
Tworzenie halogenków kwasowych
Pochodne kwasów karboksylowych (halogenki kwasowe) mogą powstawać w wyniku wymiany grupy hydroksylowej, stanowiącej grupę karboksylową z atomem fluorowca (fluor, chlor, brom, jod). Do ich tworzenia wykorzystuje się reakcje kwasów karboksylowych m. in. z chlorkami fosforu (, ), bromkami fosforu () czy chlorkiem tionylu.
Reakcje nienasyconych kwasów karboksylowych
A. Reakcja uwodornienia (addycji HIndeks dolny 22)
Np. reakcja uwodornienia kwasu propenowego:
Reakcja uwodornienia kwasu oktadec‑9-enowego (oleinowego):
B. Reakcja addycji fluorowca
Reakcja addycjiReakcja addycji bromu (bromowania) do kwasu oktadec‑9-enowego (oleinowego):
C. Reakcja utleniania nienasyconych kwasów tłuszczowych
Schemat reakcji utlenienia kwasu oktadec‑9-enowego (oleinowego) pod wpływem roztworu manganianu(VII) potasu w środowisku kwasowym. Jest to reakcja utlenienia, ponieważ atomy węgla przy wiązaniu podwójnym zmieniają stopień utlenienia z -I na III.
Podsumowanie
Ze względu na obecność grupy karboksylowej, kwasy karboksylowe mogą ulegać różnym reakcjom, m.in.:
z udziałem wodoru grupy karboksylowej (reakcje: z metalami, tlenkami metali, wodorotlenkami, solami słabszych kwasów);
z udziałem grupy hydroksylowej, stanowiącej grupę karboksylową (reakcje: estryfikacji, z amoniakiem, tworzenie halogenków kwasowych);
z udziałem grupy karbonylowej, stanowiącej grupę karboksylową (reakcja redukcji – uwodornienia czy reakcja dekarboksylacji).
Kwasy karboksylowe mogą ulegać jeszcze innym reakcjom, np.:
reakcji spalania;
utleniania nienasyconych kwasów tłuszczowych.
Słownik
(łac. functio „czynność”) atom lub grupa atomów w związkach organicznych, która decyduje o właściwościach danego związku oraz jego przynależności do danej klasy związków
klarowny, nasycony, wodny roztwór wodorotlenku wapnia
reakcja, która polega na przyłączeniu atomów pierwiastka lub cząsteczki związku chemicznego do cząsteczki posiadającej wiązanie nienasycone (podwójne lub potrójne). W reakcji addycji powstaje jeden produkt
(oksydacja – fr. oxygéne „kwasoród”) tlenreakcja, która polega na oddawaniu elektronów przez atomy lub jony pierwiastka, co skutkuje podwyższeniem ich stopnia utlenienia
(łac. reductio „cofnięcie”, „odzyskanie”) reakcja, która polega na przyjmowaniu elektronów przez atomy lub jony pierwiastka, co skutkuje obniżeniem ich stopnia utleniania
liczba ładunku elementarnego, jaki posiadałby atom, gdyby w danej substancji wszystkie wiązania były jonowe
alkohol, gdzie grupa funkcyjna – grupa hydroksylowa – jest przyłączona do pierwszorzędowego atomu węgla (atom węgla, który jest połączony z jednym atomem węgla w cząsteczce). Przykładem alkoholu pierwszorzędowego jest propan‑1-ol
reakcja przyłączenia cząsteczki wodoru do danego związku chemicznego; jest to reakcja redukcji
substancja, która wprowadzona do mieszaniny reakcyjnej przyspiesza reakcję chemiczną, ale nie zużywa się w niej. Katalizator można odzyskać po zakończeniu reakcji chemicznej
reakcja polegająca na eliminacji grupy karboksylowej z cząsteczki kwasu karboksylowego, jego soli czy estru; w wyniku reakcji powstaje również tlenek węgla(IV)
sól, która zawiera w sieci krystalicznej swojej cząsteczki wodę, np.: (siarczan(VI) wapnia – woda (1/2))
związki organiczne, których cząsteczki zawierają grupę funkcyjną karboksylową () oraz długi łańcuch węglowodorowy; są naturalnymi składnikami tłuszczy
kwas, który w roztworze wodnym tylko częściowo dysocjuje na jony. Stopień dysocjacji elektrolitycznej słabych kwasów jest mniejszy od 1. Przykładem takiego kwasu może być kwas węglowy
kwas, który w roztworze wodnym całkowicie dysocjuje na jony. Stopień dysocjacji elektrolitycznej mocnych kwasów jest równy 1. Przykładem takiego kwasu może być kwas azotowy(V)
liczba wyrażona w procentach lub w ułamku, ukazująca stosunek cząsteczek, które rozpadły się na jony podczas dysocjacji elektrolitycznej, do liczby cząsteczek wprowadzonej do roztworu
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004.
Bobrański B., Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska- Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla Liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 200.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Hiegiel G. A., Crystallization of sodium acetate. Journal of Chemical Education, t. 57, (2), 152.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
Litwin M., Styka – Wlazło SZ., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
McMurry J., Chemia organiczna 4, Warszawa 2004.
McMurry J., Chemia organiczna 3, Warszawa 2003.
Pazdro K. M., Rola – Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.


