Przeczytaj
Zjawisko procesu rozpuszczalnościrozpuszczalności nie jest Ci obce, ponieważ wykorzystujesz je w codziennym życiu. Pozwala Ci ono m.in. posłodzić kawę czy herbatę, możesz dzięki niemu rozpuścić sól w zupie. Rozpuszczalność więc jest to zdolność substancji do tworzenia z innymi substancjami roztworówroztworów lub mieszanin jednorodnych.
Miarą rozpuszczalności jest maksymalna ilość substancji chemicznej, rozpuszczająca się w 100 gramach ciekłego rozpuszczalnika w danych warunkach (temperatury i ciśnienia) w celu otrzymania roztworu nasyconego.
Poniżej przedstawiono przykład procesu rozpuszczania dla w wodzie. W trakcie dochodzi do wymieszania się drobin ciała stałego (substancji rozpuszczonej) z cząsteczkami rozpuszczalnika (wody). Taki proces jest procesem fizycznym, ponieważ podczas jego przebiegu nie tworzą się nowe cząsteczki innych związków (jak w przypadku reakcji chemicznych), a całość można odwrócić, powracając do składników początkowych.

Rozpuszczalność substancji w wodzie jest bardzo zróżnicowana i dlatego substancje dzielą się na:
dobrze rozpuszczalne ( 74,5 g na 100 g wody);
słabo rozpuszczalne ( 5 g na 100 g wody);
praktycznie nierozpuszczalne.
I chociaż te ostatnie nazywane są praktycznie nierozpuszczalnymi, to w rzeczywistości wykazują one znikomą rozpuszczalność. Przykładem takiego związku jest chlorek srebra (), którego rozpuszczalność wynosi zaledwie 1,44 · 10Indeks górny -4-4 g na 100 g wody. Kiedy stężenie substancji rozpuszczonej w roztworze wynika dokładnie z jej rozpuszczalności w danych warunkach, mówi się, że roztwór jest nasycony tą substancją. Aby zrozumieć pojęcie roztworu nasyconego, wyobraź sobie, że niewielką ilość cukru rozpuszczasz w szklance wody, następnie dodajesz kolejną porcję cukru i mieszasz, żeby ją rozpuścić. Proces ten powtarzasz do momentu, w którym – po dodaniu kolejnej porcji cukru – cukier pomimo mieszania już się nie rozpuszcza i pozostaje na dnie szklanki (tzn. osiągnięto granicę rozpuszczalności), a otrzymany w ten sposób roztwór jest roztworem przesyconym. Roztwory przesycone są przykładami substancji w stanie termodynamicznym niestabilnym metatrwałym. Otrzymany w taki sposób roztwór jest nadal roztworem nasyconym.
Jakie czynniki wpływają na szybkość rozpuszczania?
Mieszanie
Substancje ulegają szybciej rozpuszczeniu na skutek mieszania, ponieważ w jego trakcie cząsteczki substancji rozpuszczanej w szybszym czasie spotykają się z większą liczbą cząsteczek rozpuszczalnika.
Rozdrobnienie substancji rozpuszczanej
Im bardziej rozdrobniona substancja rozpuszczona, tym proces jej rozpuszczania zachodzi szybciej, ponieważ ze względu na zwiększoną powierzchnię kontaktu rozpuszczalnik szybciej przenika do drobin substancji rozpuszczanej. Przykładem tego może być rozpuszczanie cukru (lub siarczanu(VI) miedzi (II)) w postaci kostek oraz cukru w postaci drobnego kryształu. Gdybyśmy dokonali pomiaru czasu rozpuszczania (takich samych naważek) dwóch próbek, okazałoby się, że szybciej ulega rozpuszczeniu cukier w postaci bardziej rozdrobnionej.
Temperatura
Zmiana temperatury wpływa na szybkość rozpuszczania substancji. Wraz ze wzrostem temperatury rośnie energia kinetyczna cząstek, przez co zderzenia stają się bardziej efektywne i proces rozpuszczania zachodzi szybciej. Dla większości substancji stałych, wraz ze wzrostem temperatury rośnie ich rozpuszczalność w wodzie, czego w tym wypadku przykładem może być azotyn potasu (). Jednak istnieją również substancje, dla których szybkość rozpuszczalności wraz ze wzrostem temperatury maleje – do takich należą gazy (np. chlorowodór, tlenek siarki (IV)) oraz sól stała siarczan(VI) ceru ().
Poniżej przedstawiona jest zależność rozpuszczalności substancji w wodzie od temperatury, co obrazują krzywe rozpuszczalności.
Zapoznaj się z opisem zależności rozpuszczalności substancji w wodzie od temperatury, co obrazują krzywe rozpuszczalności.
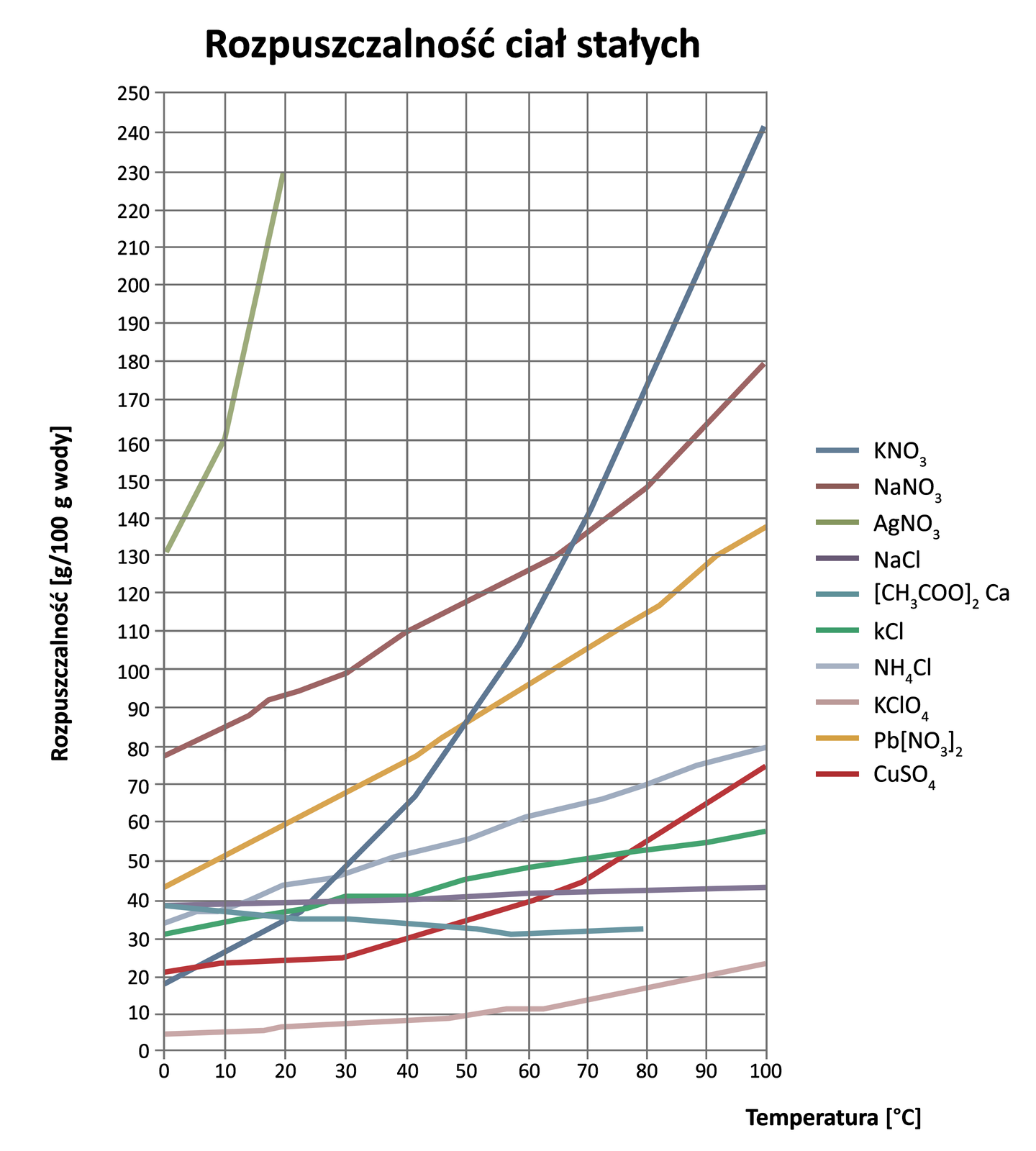
Rozpuszczalność gazów zależy od ciśnienia i rośnie wraz z jego wzrostem. Podobnie jak różny wpływ wywiera temperatura na rozpuszczalność, tak wzrost ciśnienia może powodować znaczne zwiększenie rozpuszczalności, tak jak dla dwutlenku węgla, bądź nie powodować tak dużych zmian, jak w przypadku tlenu.

Dla substancji gazowych stężenie substancji rozpuszczonych () jest proporcjonalne do ciśnienia cząstkowego (). Zależność tę określa prawo Henry’ego dla gazu idealnego:
gdzie:
k – stała proporcjonalności, która zależy od rodzaju gazu i rozpuszczalnika oraz od temperatury roztworu.
Słownik
oznacza jednorodną mieszaninę dwóch lub więcej substancji; najczęściej jeden ze składników tej mieszaniny występuje w większej ilości i wówczas nazywany jest rozpuszczalnikiem, a więc substancją służącą do rozpuszczenia innych składników (substancji rozpuszczonych)
zdolność substancji do tworzenia z innymi substancjami roztworów jednorodnych
reakcja chemiczna, która przebiega z wydzieleniem energii z układu reakcyjnego do otoczenia
reakcja chemiczna, która przebiega z pochłanianiem energii z otoczenia do układu reakcyjnego
Bibliografia
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i niorganiczna, Gdynia 2005.