Przeczytaj
Alkohole to związki organiczne, podatne na działanie czynników utleniających, które mogą utlenić się do:
związków karbonylowych (aldehydów lub ketonów) pod wpływem słabych utleniaczy – tlenku miedzi() w podwyższonej temperaturze;
kwasów karboksylowych pod wpływem silnych utleniaczy – dichromianu() potasu w środowisku kwasu siarkowego().
Utlenianie alkoholi pod wpływem tlenku miedzi() i ogrzewania
Alkohole pierwszorzędowe
Alkohole pierwszorzędowe (alkohole, w których grupa hydroksylowa przyłączona jest do atomu węgla, połączonego z jednym atomem węgla) utleniają się za pomocą tlenku miedzi() w podwyższonej temperaturze do aldehydówaldehydów , zgodnie ze schematem:
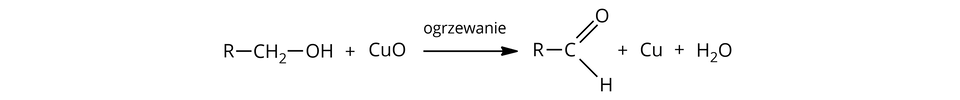
– grupa alkilowa/pierścień węglowy, pierścień aromatyczny
Przykładowo, utlenianie etanolu za pomocą tlenku miedzi() prowadzi do otrzymania acetaldehydu:
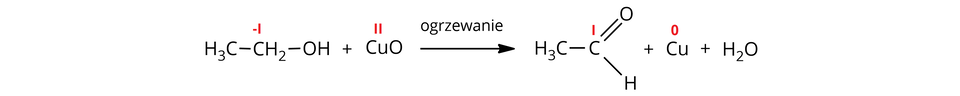
W powyższej reakcji nastąpiło utlenienie atomu węgla w ugrupowaniu (stopień utlenienia: ) do atomu węgla w grupie aldehydowej (stopień utlenienia: ) oraz redukcja atomów miedzi z na stopień utlenienia.
Alkohole drugorzędowe
Alkohole drugorzędowe (alkohole, w których grupa hydroksylowa przyłączona jest do atomu węgla, związanego z dwoma atomami węgla) utleniają się za pomocą tlenku miedzi() w podwyższonej temperaturze do ketonówketonów , zgodnie ze schematem:
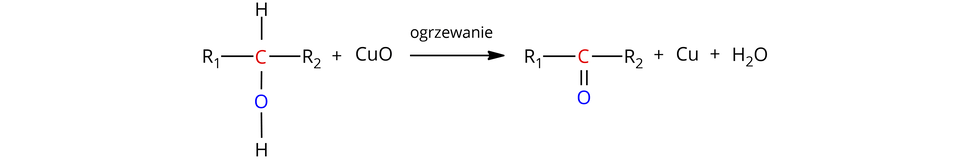
, – grupa alkilowa/pierścień węglowy/pierścień aromatyczny (mogą być tymi samymi grupami lub różnymi)
Przykładowo utlenianie butan--olu za pomocą tlenku miedzi() prowadzi do otrzymania butan--onu:

W powyższej reakcji nastąpiło utlenienie atomu węgla połączonego z grupą hydroksylową (stopień utlenienia: ) do atomu węgla w grupie karbonylowej butan--onu (stopień utlenienia: ) oraz redukcja atomów miedzi z na stopień utlenienia.
Alkohole trzeciorzędowe
Alkohole trzeciorzędowe nie ulegają utlenianiu za pomocą tlenku miedzi() w podwyższonej temperaturze, ponieważ obecność trzech grup węglowych, przyłączonych do atomu węgla związanego z grupą hydroksylową, uniemożliwia przekształcenie grupy hydroksylowej w grupę karbonylową bez zrywania wiązań węgiel‑węgiel (atom węgla nie może być pięciowiązalny).
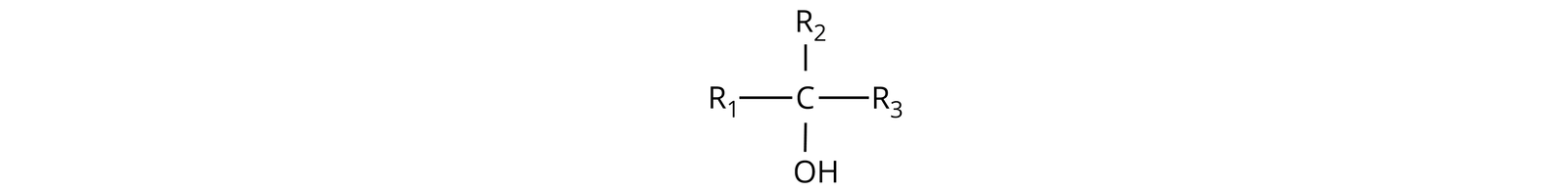
R1, R2 R3 – grupa alkilowa/pierścień węglowy/pierścień aromatyczny (mogą być tymi samymi grupami lub różnymi)
Utlenianie alkoholi pod wpływem dichromianu() potasu w środowisku kwasu siarkowego()
Alkohole pierwszorzędowe
Alkohole pierwszorzędowe (alkohole, w których grupa hydroksylowa przyłączona jest do atomu węgla, związanego z jednym atomem węgla) utleniają się za pomocą dichromianu() potasu w środowisku kwasu siarkowego() do kwasów karboksylowychkwasów karboksylowych , zgodnie ze schematem:
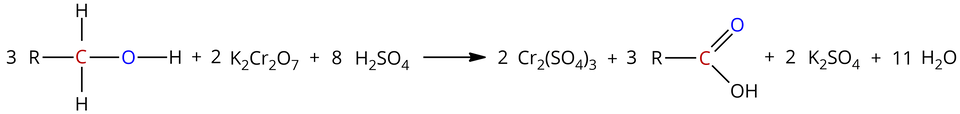
– grupa alkilowa/pierścień węglowy, pierścień aromatyczny
Przykładowo, utlenianie etanolu za pomocą dichromianu() potasu w środowisku kwasu siarkowego() prowadzi do otrzymania kwasu octowego:
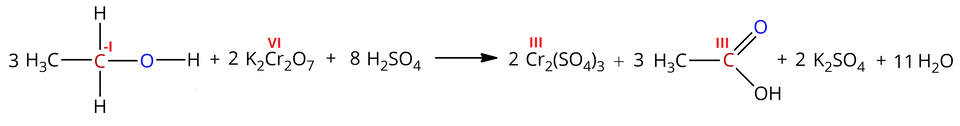
W powyższej reakcji nastąpiło utlenienie atomu węgla w ugrupowaniu (stopień utlenienia: ) do atomu węgla w grupie karboksylowej (stopień utlenienia: ) oraz redukcja atomów chromu z na stopień utlenienia. Obserwując przebieg reakcji, widzimy zmianę zabarwienia roztworu z pomarańczowego (dichromianu() potasu) na zielony (siarczan() chromu()).
Alkohole drugorzędowe
Alkohole drugorzędowe (alkohole, w których grupa hydroksylowa przyłączona jest do atomu węgla, związanego z dwoma atomami węgla) utleniają się za pomocą dichromianu() potasu w środowisku kwasu siarkowego() do ketonówketonów , zgodnie ze schematem:
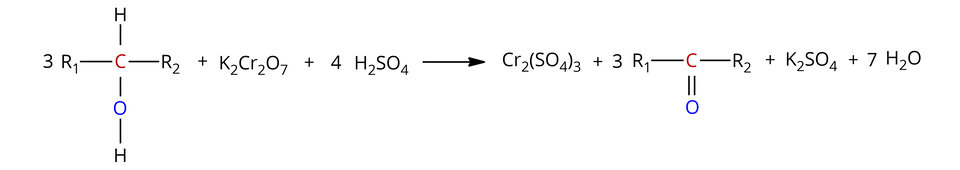
, – grupa alkilowa/pierścień węglowy/pierścień aromatyczny (mogą być tymi samymi grupami lub różnymi)
Przykładowo, utlenianie butan--olu za pomocą dichromianu() potasu w środowisku kwasu siarkowego() prowadzi do otrzymania butan--onu:
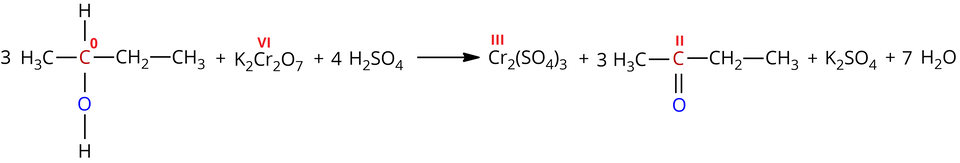
W powyższej reakcji nastąpiło utlenienie atomu węgla, połączonego z grupą hydroksylową (stopień utlenienia: ) do atomu węgla w grupie karbonylowej butan--onu (stopień utlenienia: ) oraz redukcja atomów chromu z na stopień utlenienia.
Alkohole trzeciorzędowe
Alkohole trzeciorzędowe nie ulegają bezpośrednio utlenieniu, jednak w obecności kwasu szybko ulegają dehydratacji do alkenów, a te z kolei już mogą ulegać utlenianiu.
Słownik
czynnik utleniający, substancja powodująca utlenianie innych substancji
(łac. alcohol dehydrogenatum alkohol pozbawiony wodoru) związek organiczny, który zawiera grupę aldehydową (); powstaje przez utlenianie alkoholu pierwszorzędowego
związek organiczny, który zawiera grupę karbonylową (), połączoną z dwoma takimi samymi lub różnymi grupami, powstający przez utlenianie alkoholu drugorzędowego
związek organiczny, zawierający grupę karboksylową ()
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2, Warszawa 2016.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, tłum. Wiesław Antkowiak i in., Warszawa 1985.