Przeczytaj
Szybkość reakcji chemicznej
Szybkość reakcji chemicznejSzybkość reakcji chemicznej opisywana jest przez zmianę stężeniastężenia substratów lub zmianę stężenia produktów w jednostce czasu.
Ilość substratu podczas reakcji maleje w jednostce czasu, dlatego przed zmianą stężenia substratu jest znak minus.
Jak obliczyć szybkość reakcji chemicznej opisanej równaniem , jeśli wiadomo, że w chwili rozpoczęcia reakcji stężenie substratu B w mieszaninie reakcyjnej wynosiło , a po 30 sekundach trwania reakcji jego stężenie wynosiło ?
Szybkość reakcji chemicznych zależy od:
rodzaju oraz chemicznego charakteru reagujących substancji;
stężenia substratów;
temperatury;
ciśnienia (w przypadku substancji gazowych);
rodzaju rozpuszczalnika;
pHpH;
obecności katalizatorakatalizatora.
Wpływ stężenia reagentów na szybkość reakcji chemicznej może zostać wyznaczony eksperymentalnie poprzez zmianę stężenia jednego z reagentów w tych samych warunkach (ciśnienia i temperatury).
Stężenie reagentówreagentów jest możliwe do oznaczenia, np. poprzez pomiar zmian ciśnienia (reakcje w fazie gazowej) lub pośrednio, np. dokonując pomiaru parametrów fizykochemicznych, takich jak:
pojawienie lub zanikanie barwy;
pojawienie lub zanikanie osadu lub zmętnienia;
pH;
przewodnictwoprzewodnictwo;
gęstośćgęstość.
Jak szybko przebiegnie reakcja metalu z kwasem solnym w zależności od stężenia użytego kwasu?
Należy przygotować trzy probówki oraz drut żelazny.
Do każdej z probówek dodać 5 kwasu solnego:
I probówka: 0,5 ;
II probówka: 2 ;
III probówka: 5 .
Dodaj taką samą ilość drutu żelaznego. Po kilku minutach porównaj procesy zachodzące w probówkach oraz zanotuj obserwacje i wnioski.

Wpływ stężenia substratów na szybkość reakcji chemicznej wyjaśnia teoria zderzeń aktywnych. Zwiększenie stężenia substratów na ogół zwiększa szybkość reakcji, ponieważ więcej reagujących cząsteczek lub jonów jest obecnych w celu wytworzenia produktów reakcji. Ze wzrostem stężenia rośnie liczba zderzeń, w tym również zderzeń efektywnychzderzeń efektywnych. Im większe stężenie substratu, tym większe prawdopodobieństwo zderzenia. Zostało to zobrazowane na poniższym rysunku.
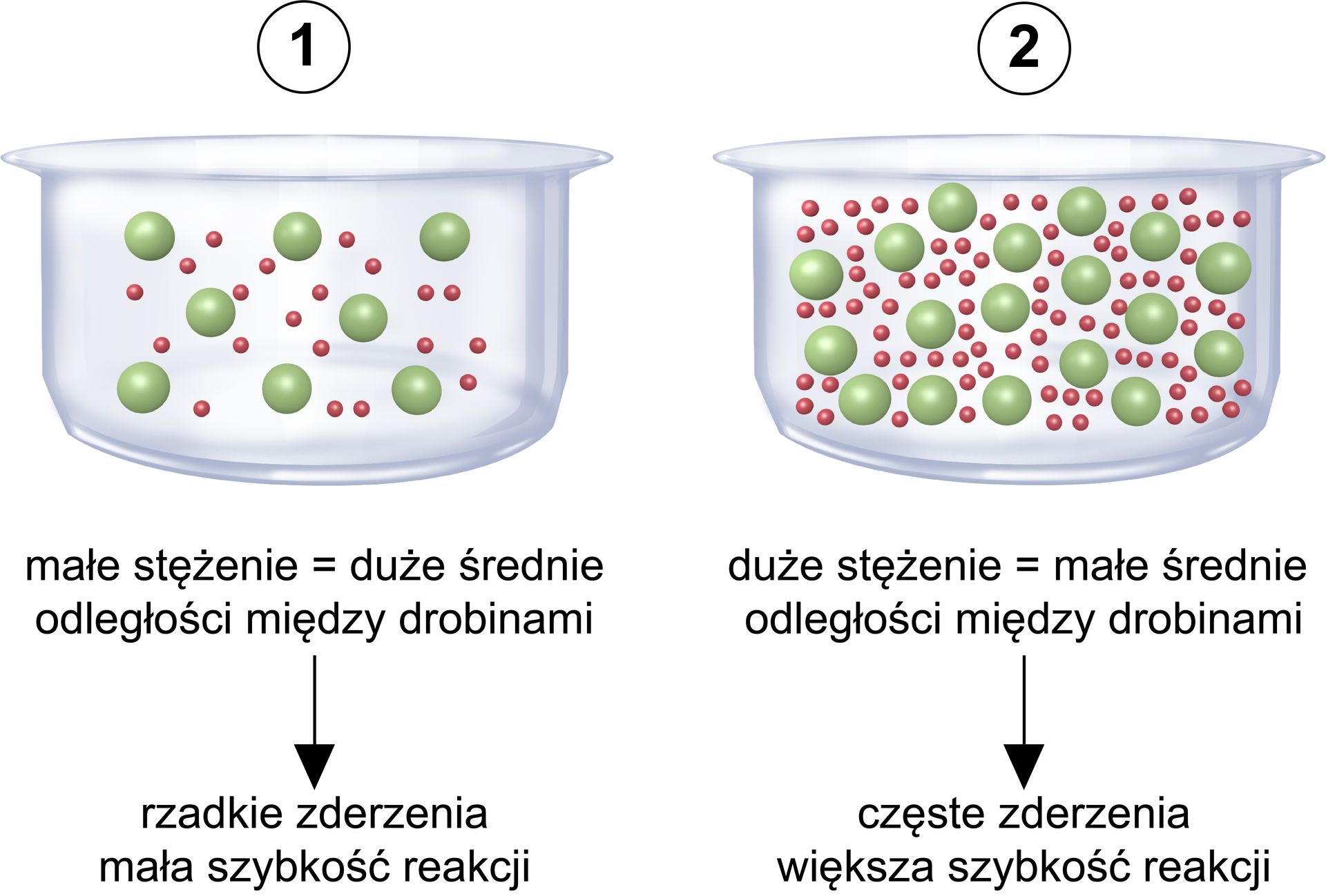
Szybkość reakcji ogólnie zmienia się bezpośrednio ze zmianami stężenia substratów. Gdy stężenie wszystkich substratów wzrasta, więcej cząsteczek lub jonów reaguje, tworząc nowy produkt, a szybkość reakcji wzrasta. Gdy stężenie substratu zmniejsza się, występuje mniej cząsteczek lub jonów, to szybkość reakcji się zmniejsza.
Zależność szybkości reakcji chemicznej od stężenia substratów jest cechą indywidualną danej reakcji. Sposobem na jej ustalenie jest przeprowadzenie eksperymentu. Wyniki pomiarów zazwyczaj przedstawiane są w postaci równania kinetycznego, z którego wynika, że szybkość większości jednoetapowych reakcji chemicznych jest wprost proporcjonalna do stężenia substratów.
Równanie reakcji, w której szybkość reakcji zależna jest w sposób liniowy od stężenia jednego z substratów, można przedstawić za pomocą równania kinetycznego reakcji I rzędu:
- szybkość reakcji chemicznej, ;
- stała szybkości reakcji chemicznej;
- stężenie substratu A, .
Równanie kinetyczne, w którym szybkość reakcji jest uzależniona w sposób wprost proporcjonalny do stężenia dwóch substratów, może przyjmować postać:
- szybkość reakcji chemicznej, ;
- stała szybkości reakcji chemicznej;
- stężenie substratu A/B, .
Jednostka stałej szybkości reakcji zależy od rzędowości reakcji, z jaką mamy do czynienia. Rzędowość określamy jako sumę wykładników potęgowych, do których podniesione są stężenia substratów w równaniu kinetycznym. W naszych powyższych przypadkach mamy do czynienia kolejno z reakcją I i II rzędu. Wartość stałej szybkości reakcji zależy od temperatury układu reagującego, nie zależy natomiast od stężenia substratów i produktów.
Oblicz, jak zmieni się szybkość reakcji chemicznej, która przebiega wg równania kinetycznego , jeżeli wartości stężeń zostaną zwiększone trzykrotnie.
Pewną reakcję chemiczną, przebiegającą w fazie gazowej, można opisać następującym równaniem kinetycznym: (gdzie i to stężenia molowe substratów A i B).
Oblicz, jak zmieni się szybkość tej reakcji, jeśli przy niezmienionej liczbie moli reagentów, do jej przeprowadzenia zastosujemy naczynie o trzykrotnie mniejszej pojemności.
Jak wpływa moc kwasu na szybkość reakcji chemicznej?
Możliwe jest również porównanie szybkości reakcji chemicznej w zależności od mocy kwasumocy kwasu. Można to zobrazować na przykładzie reakcji kwasu solnego oraz ortofosforowego(V) z magnezem. Do obu reakcji należy użyć takie same objętości oraz jednakowe stężenia molowe kwasów i taką samą ilość magnezu.
Reakcja magnezu z kwasem ortofosforowym(V) przebiega wolniej niż w przypadku reakcji z kwasem solnym, chociaż do reakcji użyto takich samych objętości oraz jednakowych stężeń molowych obu kwasów. Wynika to z faktu, że szybkość reakcji chemicznej kwasu z metalem jest zależna od stężenia jonów , które pochodzą z dysocjacji elektrolitycznej kwasu.
Stężenie kationów oksoniowych w mocnym kwasie solnym jest równe jego stężeniu. Jeśli chodzi o kwas ortofosforowy(V), jego moc jest mniejsza od mocy kwasu solnego, więc stężenie kationów oksoniowych jest mniejsze od całkowitego stężenia kwasu. W obu omawianych przypadkach objętość wodoru, która wydziela się podczas reakcji magnezu z kwasami, jest taka sama, co można wywnioskować z jonowego zapisu równań obu reakcji.
Szybkość reakcji chemicznej opisywana jest przez zmianę stężenia substratów lub produktów w jednostce czasu. Aby reakcja biegła szybciej, można zwiększyć stężenia reagentów, zwiększając tym samym liczbę reagujących cząstek. Przedstawia to proste doświadczenie, które zostało zobrazowane powyżej.
Słownik
zmiana stężenia reagentów (substratów lub produktów) w jednostce czasu
substancja, która zwiększa (lub zmniejsza) szybkość reakcji chemicznej, nie naruszając stanu końcowej równowagi i właściwości termodynamicznych układu, pozostaje w stanie niezmienionym po zakończeniu reakcji
miara ilości substancji (pierwiastka, związku chemicznego, jonu bądź innego indywiduum chemicznego) w mieszaninie
substancja biorąca udział w reakcji chemicznej (substraty i produkty)
(gr. en zýmē „w zaczynie”) biokatalizatory, dawniej fermenty, białkowe katalizatory reakcji chemicznych w układach biologicznych
fiz. proces przepływu ciepła w ośrodkach ciągłych (stałych, ciekłych i gazowych), polegający na przekazywaniu energii kinetycznej bezładnego ruchu cząsteczek ośrodka z części układu o wyższej temperaturze do cząsteczek z części układu o temperaturze niższej
wielkość fizyczna, charakteryzująca rozkład przestrzenny rozważanej wielkości fizycznej, np. masy, siły, pędu, energii, ładunku elektrycznego
w kinetyce chemicznej oznacza takie zderzenie drobin substratów, w wyniku którego dochodzi do utworzenia bądź zerwania wiązań chemicznych
wykładnik jonów ; wielkość stosowana do określania odczynu roztworu
termin umowny, rozumiany jako zdolność kwasu do ulegania procesowi dysocjacji elektrolitycznej
Bibliografia
Atkins P., Jones L., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
encyklopedia.pwn.pl