Przeczytaj
Jakim reakcjom ulegają litowce?
LitowceLitowce ulegają reakcjom, tworząc szereg związków nieorganicznych i organicznych.
Litowce reagują z wodą:
Sód i potas gwałtownie reagują z wodą, przy czym reakcja potasu z wodą ma bardziej gwałtowny przebieg (potas w kontakcie z wodą zapala się). Reakcje te są egzoenergetyczne i towarzyszy im wydzielanie się bezbarwnego gazu:
Litowce reagują z tlenem:
Lit – miękki, srebrzystoszary metal – reagując z tlenem, tworzy tlenek (jako jedyny litowiec):
Sód tworzy nadtleneknadtlenek , a potas ponadtlenekponadtlenek :
Związki nieorganiczne
Reakcje z nadtlenkami i ponadtlenkami
Nadtlenek sodu reaguje z metalicznym sodem, tworząc tlenek sodu:
Ponadtlenek potasu reaguje z potasem, tworząc kolejno nadtlenek i tlenek potasu:
Reakcje litowców z kwasami
Litowce z łatwością reagują z kwasami i wypierają z nich wodór:
Tlenki litowców również reagują z kwasami:
Związki organiczne
Reakcje z halogenkami organicznymi
Jedną z częściej stosowanych reakcji w chemii organicznej z udziałem litowców jest reakcja Würtzareakcja Würtza. Reakcja ta zachodzi przy udziale sodu (litu lub potasu) i służy do sprzęgania halogenków alkilowych, co prowadzi do powstania nowego wiązania węgiel‑węgiel, np.:
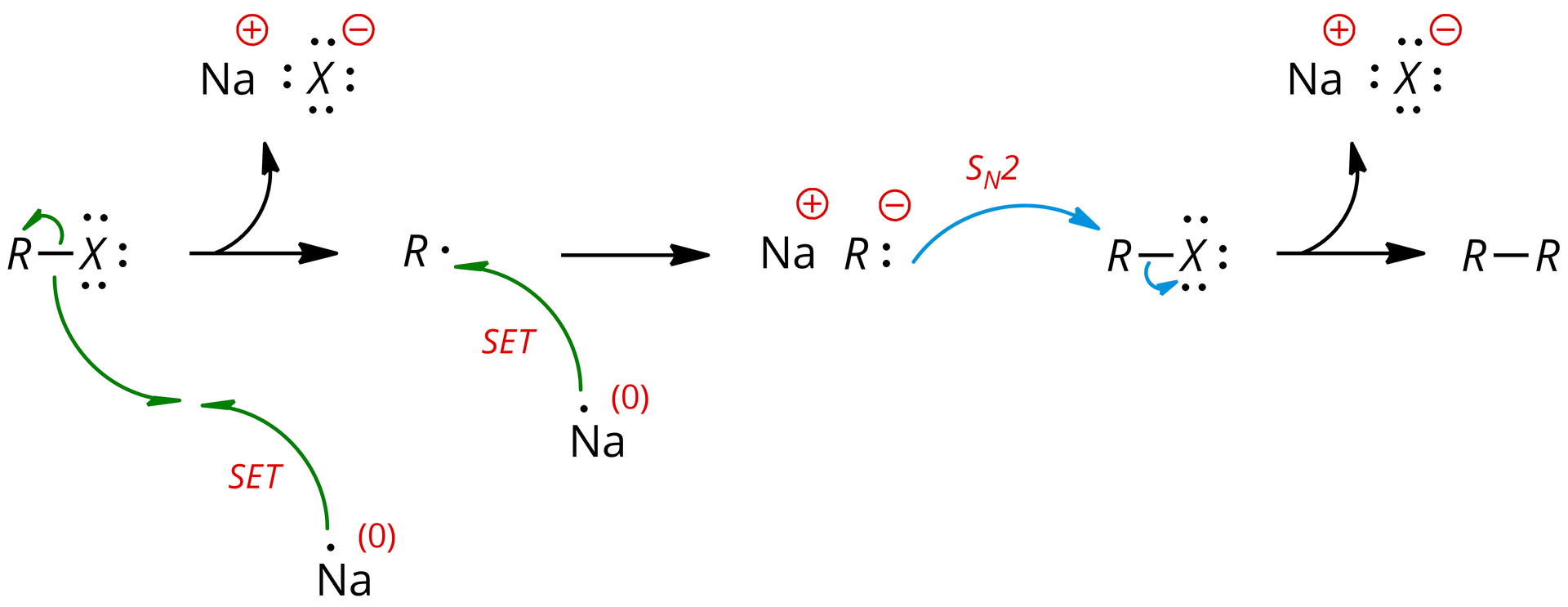
SET – , przeniesienie pojedynczego elektronu
SN2 – reakcja substytucji nukleofilowej zachodzącej poprzez mechanizm dwucząsteczkowy.
gdzie:
– grupa alkilowa;
– alkan o powiększonej liczbie atomów węgla w cząsteczce względem cząsteczki wyjściowego halogenku;
– , , , .
Reakcja polega technicznie na ogrzewaniu roztworu halogenku w obecności bardzo rozdrobnionego metalu alkalicznego.
Redukcja halogenków alkilowych metalicznym litem służy natomiast do otrzymywania odczynników litoorganicznych – ważnej klasy związków metaloorganicznych.
Otrzymywanie n-butylolitu:
Reakcje redukcji
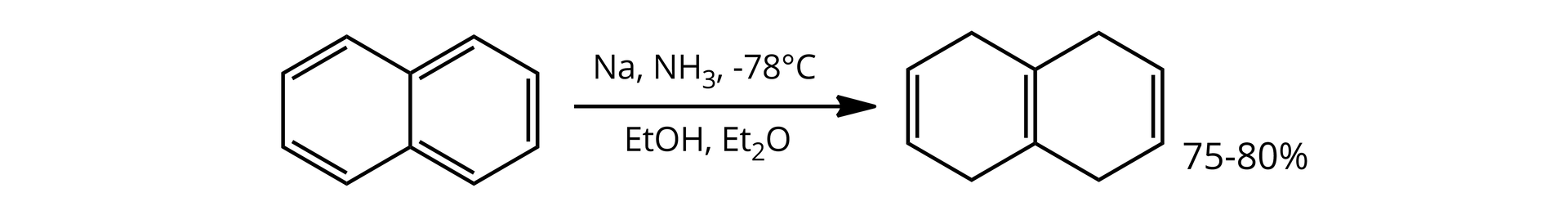
Litowce są również wykorzystywane do redukcji arenów. Jedną z reakcji stosowanych do wspomnianej redukcji węglowodorów aromatycznych jest reakcja Birchareakcja Bircha, której nazwa pochodzi o nazwiska australijskiego chemika Arthura Bircha. Przykładem tego typu reakcji jest redukcja naftalenu:
Reakcje z alkoholami (mono i polihydroksylowymi)
Sód reaguje z etanolem w środowisku bezwodnym, a produktem tej reakcji jest etanolan sodu – związek z grupy tzw. alkoholanówalkoholanów:
Reakcje z kwasami karboksylowymi
W wyniku reakcji kwasów karboksylowych z litowcami powstają sole kwasów karboksylowych. Przykładem takich soli są mrówczany, otrzymywane w reakcji kwasu mrówkowego z odpowiednim metalem, np.:
Reakcje z wyższymi kwasami karboksylowymi
Kwas oleinowy nie reaguje z większością metali – jedynie z niektórymi litowcami. W reakcji kwasu oleinowego z sodem powstaje sól sodowa kwasu oleinowego (oleinian sodu):
Zaproponuj doświadczenie za pomocą którego udowodnisz, że litowce reagują z alkoholami. Wskaż odczynniki oraz sprzęt. Następnie zapisz przewidywane obserwacje, równanie reakcji oraz wnioski.
Słownik
(czyt. bərcza) reakcja Bircha i Hückla; metoda redukcji związków organicznych za pomocą litowców (sodu, litu) w ciekłym amoniaku lub aminach alifatycznych
metale alkaliczne, pierwiastki chemiczne stanowiące pierwszą grupę układu okresowego pierwiastków: lit (), sód (), potas (), rubid (), cez () i promieniotwórczy frans ()
związki organiczne, pochodne alkoholi, o cząsteczkach, w których atom wodoru grupy hydroksylowej jest zastąpiony atomem metalu
reakcja chemiczna polegająca na działaniu metalicznym sodem na mono- albo difluorowcopochodne alkilowe (zazwyczaj bromopochodne), w której otrzymuje się adekwatnie węglowodory o długich łańcuchach i związki cykliczne
związki chemiczne o cząsteczkach zawierających grupę nadtlenkową , w której tlen występuje na stopniu utlenienia, pochodne nadtlenku wodoru , w którego cząsteczce obydwa atomy wodoru zostały zastąpione atomami metali — nadtlenki nieorganiczne, lub grupami organicznymi — nadtlenki organiczne
związki metali z tlenem, o wzorze ogólnym , w których występuje anion ponadtlenkowy
Bibliografia
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia: Liceum – poziom podstawowy i rozszerzony, Wydawnictwo Szkolne PWN, Warszawa – Bielsko‑Biała 2010.