Przeczytaj
Czym jest szybkość reakcji chemicznej?
Szybkość reakcji chemicznejSzybkość reakcji chemicznej definiowana jest przez zmianę stężeniastężenia substratów lub zmianę stężenia produktów w jednostce czasu.
Ilość substratu podczas reakcji maleje w jednostce czasu, dlatego przed zmianą stężenia substratu jest znak minus.
Szybkość reakcji chemicznych zależy od:
- Nazwa kategorii: Szybkość reakcji chemicznych zależy od:
- Nazwa kategorii: Rodzaju oraz chemicznego charakteru reagujących substancji
- Nazwa kategorii: Stężenia substratów
- Nazwa kategorii: Ciśnienia (w przypadku substancji gazowych)
- Nazwa kategorii: Temperatury
- Nazwa kategorii: Obecności katalizatora Koniec elementów należących do kategorii Szybkość reakcji chemicznych zależy od:
- Elementy należące do kategorii Szybkość reakcji chemicznych zależy od:
Badanie zależności szybkości reakcji metalu z kwasem siarkowym() od stężenia użytego kwasu.
Czy stężenie reagentów wpływa na szybkość zachodzącej reakcji chemicznej?
Stężenie reagentów wpływa na szybkość zachodzącej reakcji chemicznej.
1. Do dwóch probówek dodaj po kilka centymetrów sześciennych kwasu siarkowego(VI) – do pierwszej o stężeniu 0,5 , do drugiej o stężeniu 1 .
2. Do każdej z probówek dodaj wiórki magnezu.
3. Porównaj procesy zachodzące w probówkach, policz ilość wydzielanych pęcherzyków gazu oraz zanotuj obserwacje i wnioski.
Schemat doświadczenia:
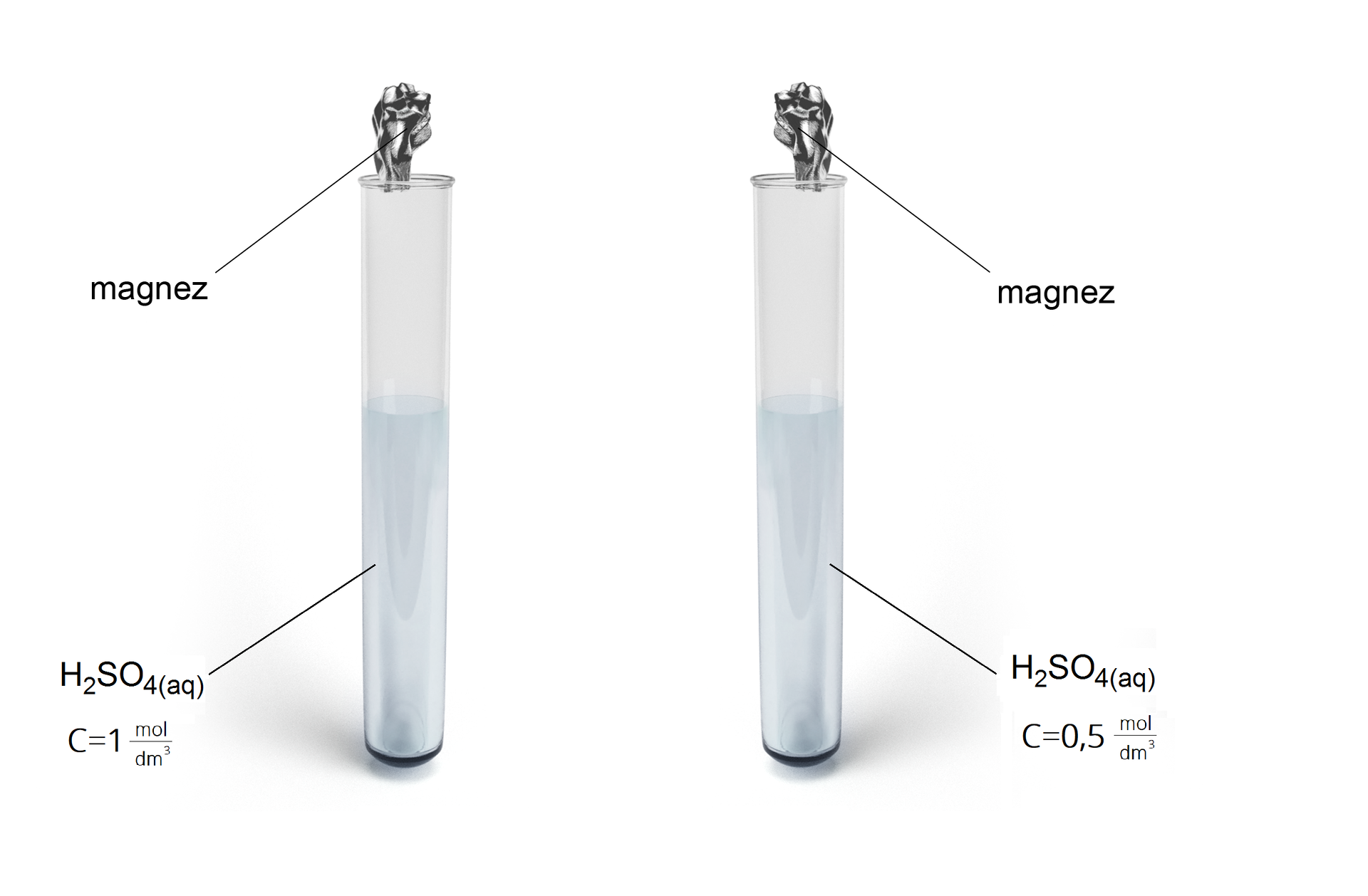
W probówce, w której znajduje się wodny roztwór kwasu siarkowego(VI) o stężeniu 1 , wydziela się więcej pęcherzyków gazu.
Stężenie reagentów wpływa na szybkość reakcji chemicznych. Wzrost stężenia kwasu powoduje wzrost szybkości reakcji.
Zwiększenie stężenia substratów na ogół zwiększa szybkość reakcji, ponieważ więcej reagujących cząsteczek lub jonów jest obecnych w celu wytworzenia produktów reakcji. Ze wzrostem stężenia rośnie liczba zderzeń, w tym również zderzeń efektywnych. Im większe stężenie substratu, tym większe prawdopodobieństwo zderzenia. Podobnie jest w przypadku gazów – jeśli zwiększa się ciśnienie, to cząsteczki gazu są bardziej „ściśnięte” w jednostce objętości, więc są bardziej stężone. Jeśli zwiększymy ciśnienie, szybkość reakcji wzrośnie, ponieważ wzrośnie liczba zderzeń efektywnych.
Badanie wpływu temperatury na szybkość reakcji.
Czy wysokość temperatury wpływa na szybkość zachodzącej reakcji chemicznej?
Wysokość temperatury wpływa na szybkość zachodzącej reakcji chemicznej.
1. Do trzech kolb stożkowych wlej 30 cm3 kwasu azotowego(V).
2. Zawartość pierwszej kolby podgrzej do 40°C, drugiej do 75°C, a trzecią kolbę pozostaw w temperaturze pokojowej.
3. Po ogrzaniu dodaj po 15 cm3 roztworu jodku potasu i obserwuj zachodzące zmiany.
Schemat doświadczenia:

Następuje wydzielanie substancji o fioletowej barwie. Powstałe roztwory przyjmują brunatne zabarwienie różniące się intensywnością. Im wyższa temperatura roztworu w kolbie, tym reakcja zachodzi szybciej. Najwolniej w kolbie o temperaturze pokojowej, najszybciej w kolbie o temperaturze 75°C.
Podczas reakcji kwasu azotowego(V) z roztworem jodku potasu powstaje jod o fioletowym zabarwieniu. Roztwory przyjmują brunatne zabarwienie, ponieważ jod w rozpuszczalnikach polarnych tworzy brunatne roztwory. Szybkość reakcji chemicznej zależy od temperatury. Im wyższa temperatura, tym reakcja zachodzi szybciej.
Podczas wzrostu temperatury układu wzrasta również średnia energia kinetyczna każdego ze składników. Wzrost energii kinetycznej powoduje, że indywidua poruszają się szybciej i zderzają się ze sobą częściej w określonym czasie. To sprawia, że cząsteczki posiadają więcej energii przy każdym zderzeniu. Wzrost aktywności oraz energii powoduje zwiększenie szybkości reakcji oraz szybsze powstanie produktu końcowego. Szybkość praktycznie wszystkich reakcji rośnie wraz ze wzrostem temperatury. I odwrotnie, szybkość prawie wszystkich reakcji zmniejsza się wraz ze spadkiem temperatury.
Sprawdź się! Zaprojektuj doświadczenie
Zaproponuj doświadczenie, w którym zbadasz wpływ stopnia rozdrobnienia substratu na szybkość zachodzącej reakcji na podstawie reakcji kwasu solnego z metalicznym magnezem. Uzupełnij w formularzu niezbędny sprzęt i odczynniki, instrukcję wykonania doświadczenia, obserwacje oraz wnioski.
Doświadczenie
Badanie wpływu stopnia rozdrobnienia substratu na szybkość reakcji.
Schemat doświadczenia:

Zaproponuj doświadczenie, w którym zbadasz wpływ dodatku katalizatorakatalizatora na szybkość zachodzącej reakcji na podstawie reakcji kwasu solnego z cynkiem, używając roztworu siarczanu() miedzi() jako katalizatora. Uzupełnij w formularzu niezbędny sprzęt i odczynniki, instrukcję wykonania doświadczenia, obserwacje oraz wnioski.
Doświadczenie 4
Badanie wpływu obecności katalizatora na szybkość reakcji
Schemat doświadczenia:

Słownik
zmiana stężenia reagentów (substratów lub produktów) w jednostce czasu
substancja, która zmienia przebieg reakcji chemicznej, nie naruszając stanu końcowej równowagi i właściwości termodynamicznych układu, pozostając w stanie niezmienionym po zakończeniu reakcji
miara ilości substancji (pierwiastka, związku chemicznego, jonu bądź innego indywiduum chemicznego) w mieszaninie
substancja biorąca udział w reakcji chemicznej (substraty i produkty)
wykładnik jonów oksoniowych; wielkość stosowana do określania odczynu roztworu
Bibliografia
Atkins P., Jones L., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Bieniek G., Doświadczenia chemiczne w zadaniach, Kraków 2007.
Penkala T., Podstawy Chemii Ogólnej, Warszawa 1982.
encyklopedia.pwn.pl