Przeczytaj
Reakcja chemiczna to proces tworzenia nowych produktów. Zapis równania reakcji oparty jest zasadę, wg której wzory substratów umieszcza się po lewej stronie strzałki, a wzory produktów po prawej stronie. Znane są reakcje nieodwracalnenieodwracalne i odwracalneodwracalne. Dla opisu stanu równowagirównowagi dynamicznej istotne są reakcje odwracalne. Przez takie reakcje należy rozumieć te, które nie przebiegają do samego końca, lecz w trakcie ich przebiegu równolegle tworzone są cząsteczki produktów i odtwarzane cząsteczki substratów, wówczas w równaniu reakcji stosuje się dwie przeciwnie skierowane strzałki.
Czym jest stan równowagi dynamicznej?
Na skutek reakcji, zachodzącej pomiędzy cząsteczkami wodoru i azotu, tworzone są cząsteczki amoniaku. W miarę upływu czasu reakcji, stężenie cząsteczek substratów zaczynają maleć, więc reakcja syntezy amoniaku przebiega coraz wolniej (od lewej do prawej). Inaczej sytuacja wygląda dla cząsteczek produktu, których w miarę upływu czasu jest coraz więcej. Cząsteczki amoniaku zaczynają ulegać reakcji rozpadu, odtwarzając azot oraz wodór. Szybkość tej reakcji stopniowo rośnie. Trwa to do momentu zrównania się ze sobą szybkości obu omawianych reakcji. Wówczas stężenia substratów i produktów są stałe, a takie zjawisko nazywane jest stanem równowagi dynamicznej. Jego ustalenie nie oznacza, że reakcja została zahamowana. Procesy tworzenia i rozpadu cząsteczek ciągle następują, jednak zachodzą z równą szybkością.
Z powyższym zjawiskiem jest związana wielkość – stężeniowa stała równowagi reakcji. Jest ona równa ilorazowi iloczynu stężeń produktów do iloczynu stężeń substratów (podniesionych do potęg, zgodnych ze współczynnikami stechiometrycznymi), które zostały zmierzone w stanie równowagi.
Dla powyższej reakcji, stała równowagi reakcji K ma postać:
Czynnikami mającymi wpływ na stan równowagi chemicznej są:
stężenie;
temperatura;
ciśnienie (dla gazów);
objętość mieszaniny reakcyjnej.
Aby dokładniej zrozumieć istotę wpływu powyższych czynników na stan równowagi dynamicznej, należy poznać regułę przekory (regułę Le Chateliera i Brauna)przekory (regułę Le Chateliera i Brauna). Według niej układ, będący w stanie równowagi chemicznej, w momencie działania czynnika zewnętrznego (bodźca), musi zareagować tak, aby zniwelować jego działanie i osiągnąć nowy stan równowagi, możliwie niezbyt odległy od stanu równowagi wyjściowej.
Zbadajmy, jak stężenie wpływa na położenie stanu równowagi chemicznej
Reakcja syntezy jodowodoru przebiega w pewnych warunkach ciśnienia i temperatury w fazie gazowej, w układzie zamkniętym, a stała szybkości reakcji wynosi . Między reagentami ustala się stan równowagi dynamicznej. Co się stanie, jeśli do układu dostarczymy cząsteczki substratów?
Sprawdźmy, jak zmieni się wydajność tworzenia jodowodoru, gdy do reakcji – zamiast 1 mola cząsteczek jodu i 1 mola cząsteczek wodoru – użyjemy 4 mole cząsteczek jodu i 1 mol cząsteczek wodoru. Objętość reaktora to 1 dmIndeks górny 33. W takim przypadku wartości stężeń są równe liczbom moli reagentów.
A. Do powstania 1 mola jodowodoru () potrzebne jest 0,5 mol cząsteczkowego wodoru () i 0,5 mola cząsteczkowego jodu ().
Jeżeli liczbę moli jodowodoru, powstałego w wyniku reakcji, oznaczymy jako x, to liczba moli przereagowanych substratów będzie wynosiła 0,5x. Po przeprowadzeniu reakcji (stan równowagowy), liczba moli substratów będzie równa różnicy między stanem początkowym (w tym przypadku 1 mol i 1 mol ) a liczbą przereagowanych moli (0,5x).
Reagent | Stan początkowy | Przereagowanie | Stan równowagowy |
|---|---|---|---|
1 | 0,5x | 1‑0,5x | |
1 | 0,5x | 1‑0,5x | |
0 | x | x |
Korzystając ze wzoru na stałą równowagistałą równowagi dla tej reakcji:
Podstawiamy znane wielkości oraz wielkości z tabeli:
Stężenie równowagowe cząsteczek jodu oraz cząsteczek wodoru wynosi 0,07 .
Stężenie równowagowe jodowodoru wynosi 1,86 , więc wydajność reakcji możemy obliczyć z następującej proporcji:
B. Teraz należy policzyć przypadek drugi.
Jeżeli liczbę moli jodowodoru, powstałego w wyniku reakcji oznaczymy jako x, to liczba moli przereagowanych substratów będzie wynosiła 0,5x. Po przeprowadzeniu reakcji (stan równowagowy), liczba moli substratów będzie równa różnicy między stanem początkowym (w tym przypadku 1 mol i 4 mol ) a liczbą przereagowanych moli (0,5x).
Reagent | Stan początkowy | Przereagowanie | Stan równowagowy |
|---|---|---|---|
4 | 0,5x | 4‑0,5x | |
1 | 0,5x | 1‑0,5x | |
0 | x | x |
Korzystając ze wzoru na stałą równowagi dla tej reakcji:
Podstawiamy znane wielkości oraz wielkości z tabeli:
Aby rozwiązać równanie kwadratowe, należy wykorzystać matematyczne wzory:
Stężenie równowagowe cząsteczek jodu wynosi 3 , z kolei cząsteczek wodoru 0 .
Stężenie równowagowe jodowodoru wynosi 2 , więc wydajność reakcji możemy obliczyć z następującej proporcji:
Z powyższych obliczeń wynika, że wraz ze zwiększeniem stężenia jodu, wydajność tworzenia jodowodoru wzrosła – w drugim przypadku otrzymujemy 100% wydajności, natomiast w pierwszym 97%.
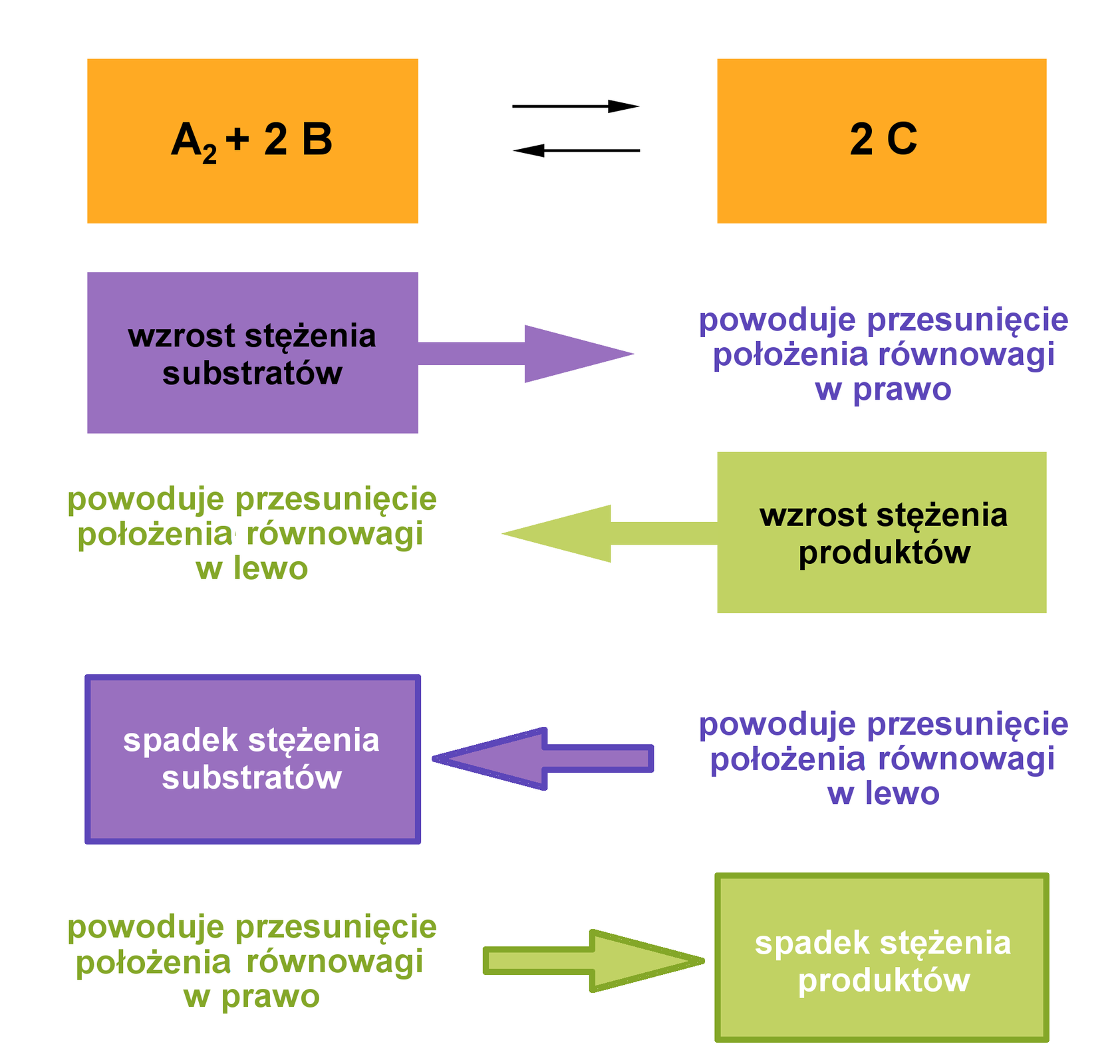
Zatem równowaga przesunęła się w prawo, w stronę tworzenia produktów. Powyższa analiza pozwala na potwierdzenie założenia reguły przekory. Podsumowując: dodatek stężenia substratów spowoduje, że układ będzie dążył do obniżenia stężenia substratów i osiągnie to poprzez tworzenie nowych cząsteczek produktów. Dojdzie więc do przesunięcia równowagi dynamicznej w prawo. (K=const., T =const.). Natomiast gdyby do układu dostarczono cząsteczek produktów, równowaga zostałaby przesunięta w lewo.
Jak temperatura wpływa na stan równowagi chemicznej?
Zależność stałej równowagi od temperatury opisuje równanie:
gdzie:
A – stała charakterystyczna dla danej reakcji;
Q – ciepło reakcji;
R – stała gazowa;
T – temperatura.
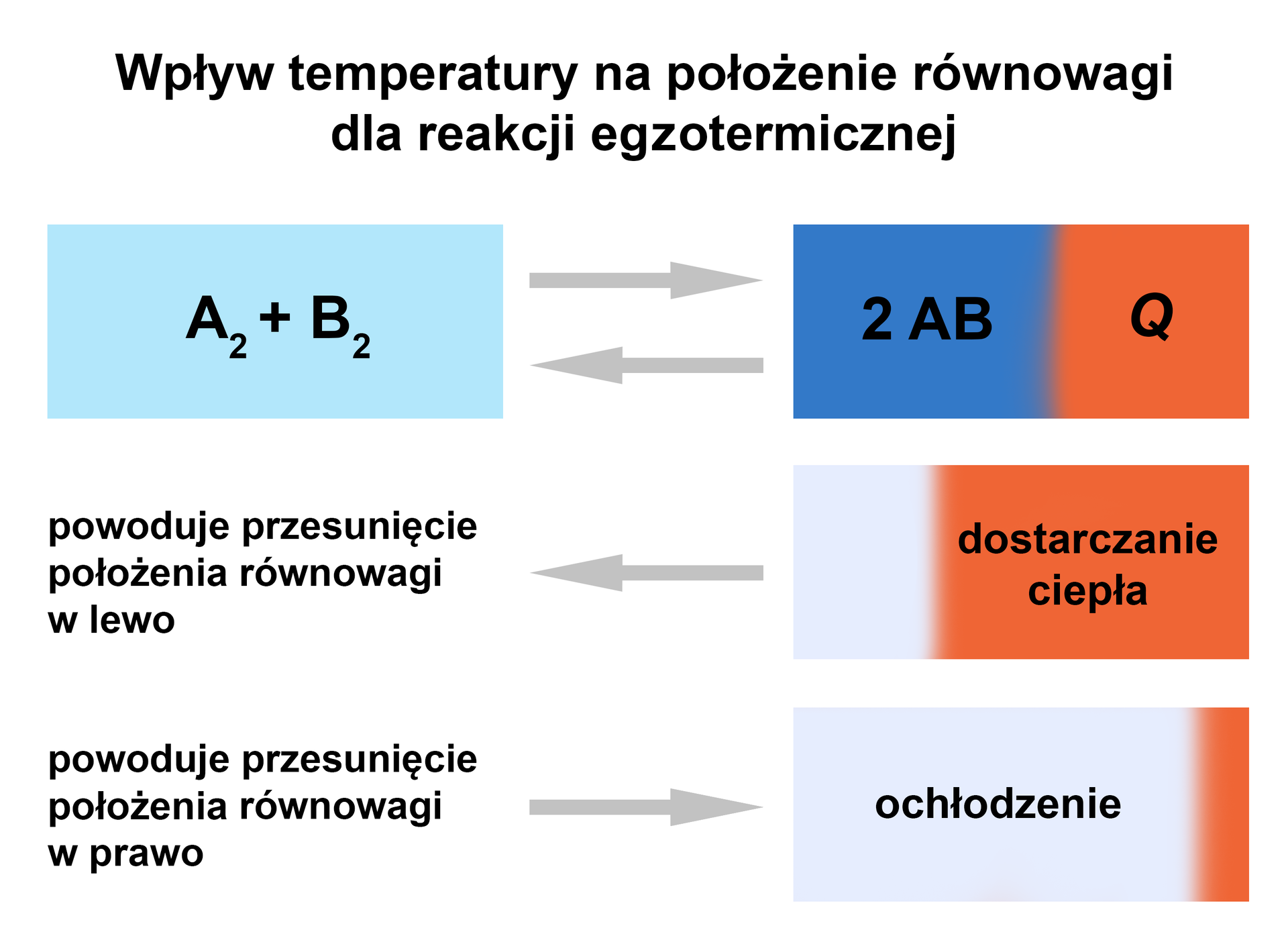
Zmiana temperatury reakcji chemicznej powoduje przesunięcie stanu równowagi chemicznej wraz ze zmianą wartości stałej równowagi dla tej reakcji. Wpływ na położenie stanu równowagi mają też zmiany stężeń reagentów. Jednak w odróżnieniu od wpływu temperatury, w tym przypadku nie zmienia się wartość stałej równowagi reakcji.
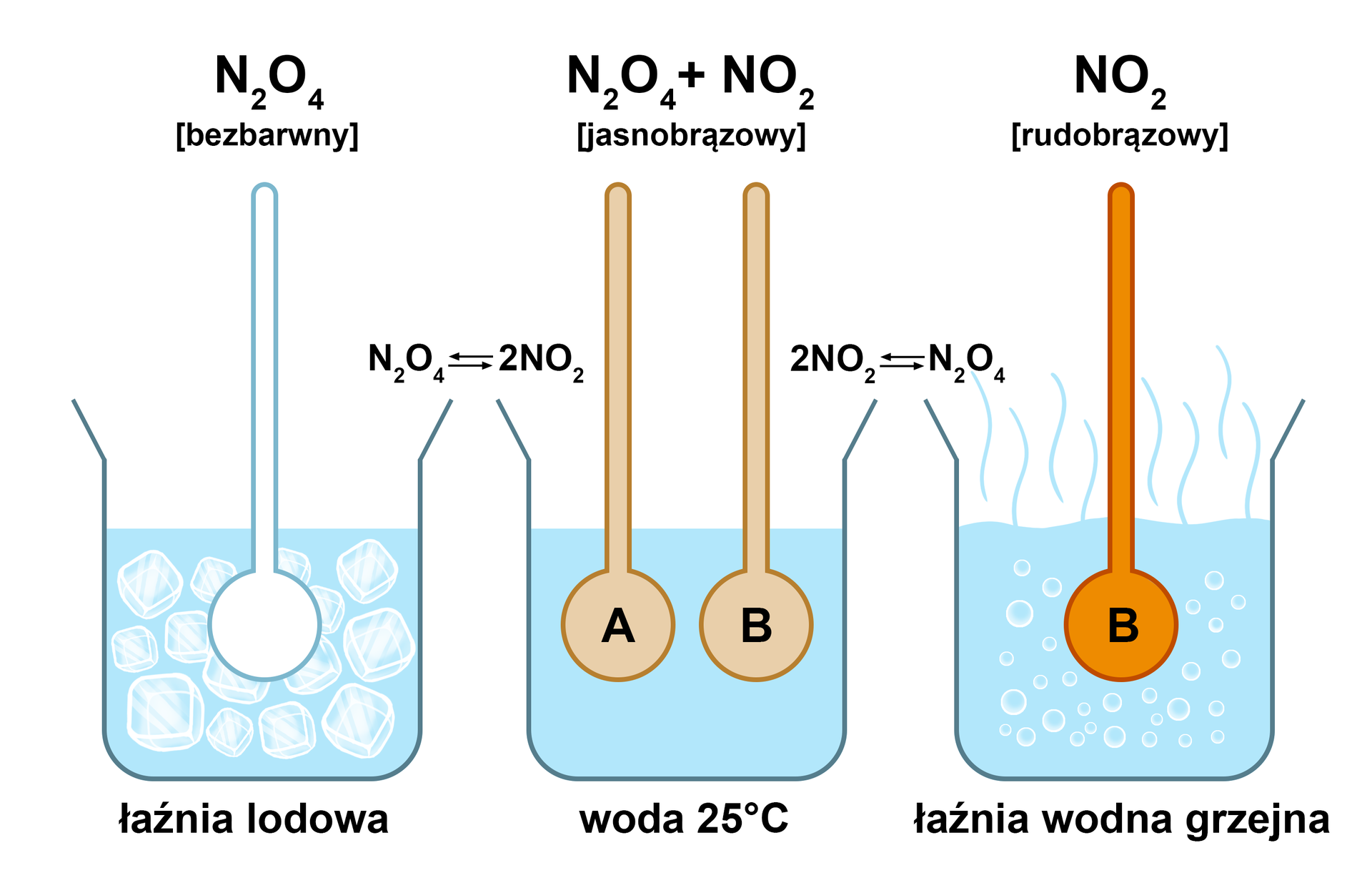
Analizując wpływ temperatury na położenie stanu równowagi, należy pamiętać, że różni się on dla reakcji egzotermicznej i endotermicznej. Reakcja egzotermiczna to ta przebiegająca z wydzieleniem ciepła (energii) (deltaH<0), natomiast reakcja endotermiczna to ta przebiegająca z pochłonięciem ciepła (energii) (deltaH>0).
Synteza amoniaku jest przykładem reakcji egzotermicznej – w jej trakcie wydziela się ciepło. Zatem zwiększenie temperatury dla tej reakcji, zgodnie z regułą przekory, spowoduje przesunięcie równowagi dynamicznej w lewo, w kierunku kompensacji tej zmiany. Wówczas wydajność tworzenia produktu będzie maleć.
Dla reakcji endotermicznej, zwiększenie temperatury spowodowałoby przesunięcie położenia stanu równowagi w prawo, by skompensować zmianę. W takim razie wydajność tworzenia produktu by rosła.
Słownik
stan, do którego dąży układ reakcyjny w trakcie przebiegu reakcji odwracalnej
reakcja chemiczna, która przebiega z wydzieleniem energii z układu reakcyjnego do otoczenia (deltaH<0)
reakcja chemiczna, która przebiega z pochłanianiem energii z otoczenia do układu reakcyjnego (deltaH>0)
ciepło () pochłaniane lub wydzielane w czasie reakcji chemicznej, które zostało zmierzone w stałych warunkach ciśnienia i temperatury w stosunku do liczności reagentów
reakcja przebiegająca tylko w jednym kierunku
reakcja, która przebiega w obu kierunkach, celem osiągnięcia stanu równowagi
reguła mówiąca, że układ będący w stanie równowagi chemicznej, poddany działaniu czynnika zewnętrznego, zareaguje w taki sposób, aby zmniejszyć wpływ tego czynnika i osiągnąć nowy stan równowagi (który będzie możliwie niezbyt odległy od stanu równowagi wyjściowej)
współczynnik opisujący stan równowagi reakcji odwracalnych; równa ilorazowi iloczynu stężeń produktów do iloczynu stężeń substratów (podniesionych do potęg zgodnych ze współczynnikami stechiometrycznymi), które zostały zmierzone w stanie równowagi
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.
Chemistry: Atoms First 2e, online: https://openstax.org/books/chemistry-atoms-first-2e/pages/13-introduction, dostęp: 23.02.2021.