Przeczytaj
Czym jest proces halogenowania?
HalogenowanieHalogenowanie jest to reakcja chemiczna polegająca na addycji (dodaniu), substytucji (podstawieniu) lub przegrupowaniu atomów pierwiastków z grupy fluorowców (halogenów) do cząsteczek związków organicznych, w wyniku czego powstają halogenopochodne.
Halogenowanie benzenu
Związki aromatyczne biorą udział w reakcjach, w których zostaje zachowany nienaruszony układ zdelokalizowanych elektronów pi. Do takich reakcji należy substytucja elektrofilowasubstytucja elektrofilowa.
Reakcja z halogenami, a przede wszystkim z chlorem lub bromem, zachodzi w obecności kwasu Lewisa, np. lub . W praktyce używa się metalicznego żelaza w postaci pyłu lub opiłków. Żelazo reaguje z bromem lub chlorem, tworząc chlorek lub bromek żelaza(). W reakcji tej tworzą się m.in. odpowiednie halogenopochodne benzenu – chlorobenzen lub bromobenzen.
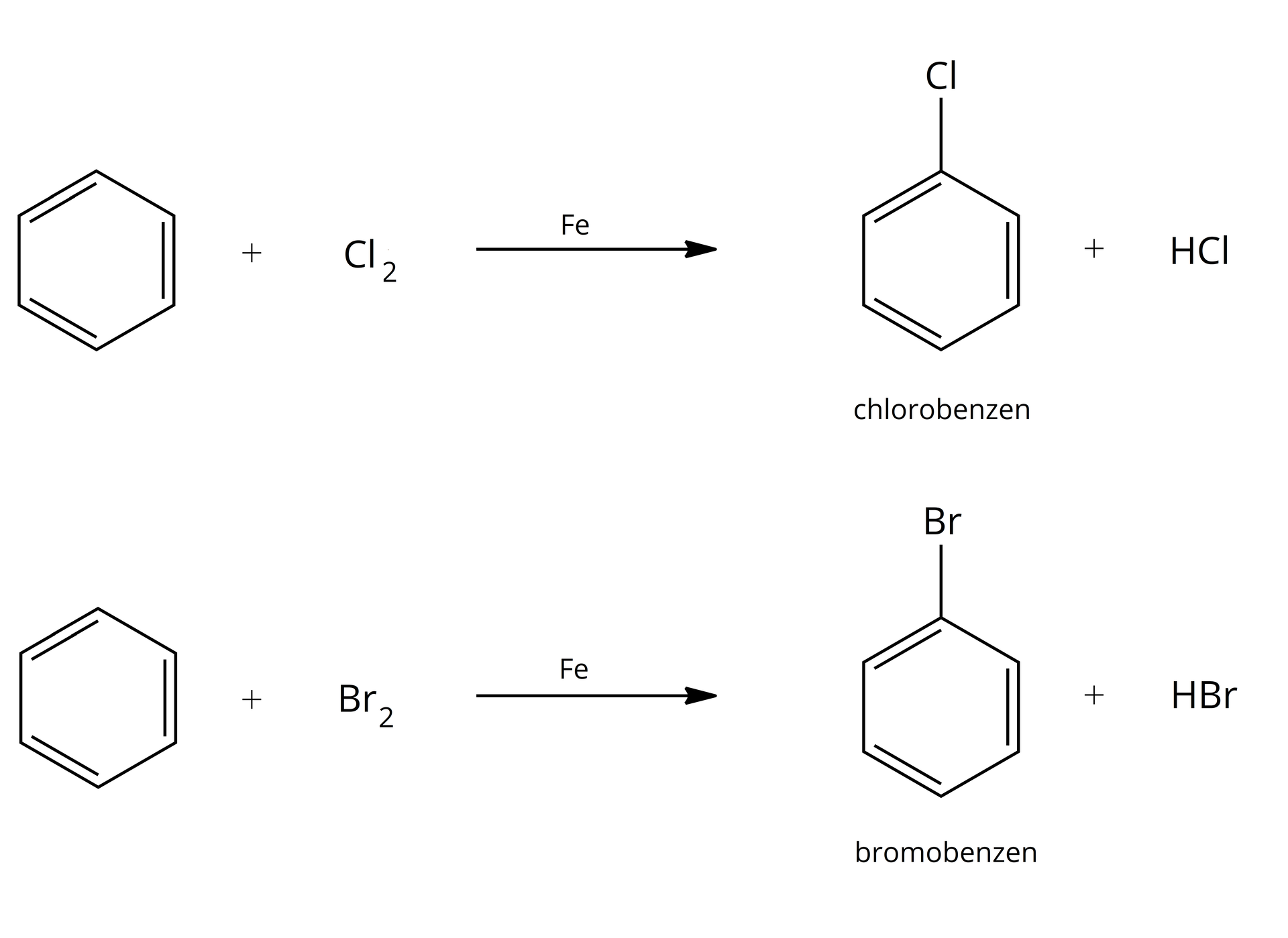
Mechanizm katalitycznego halogenowania benzenu
Reakcja przebiega w trzech etapach: tworzenie elektrofila, tworzenie kompleksu sigma oraz odtworzenie układu aromatycznego i katalizatora. W wyniku oddziaływania chmury elektronów układu aromatycznego z powstałą (z bromu i ) parą jonową, powstaje kompleks zwany kompleksem . W kolejnym etapie tworzy się wiązanie sigma między elektrofilem a jednym z atomów węgla układu aromatycznego. W powstałym kompleksie (zwanym kompleksem sigma) atom węgla, wiązany z elektrofilem, zmienia hybrydyzację z na , a ładunek dodatni jest w nim zdelokalizowany pomiędzy pozostałe pięć atomów węgla. Ostatnim etapem jest eliminacja protonu, połączona z aromatyzacją układu cyklicznego. Wyeliminowany proton rozkłada anion , odtwarzając katalizator ().
Halogenowanie pochodnych benzenu
W przypadku związków aromatycznych z bocznym łańcuchem alkilowym (np. toluenu), podczas reakcji w obecności katalizatora () następuje podstawienie pierścienia aromatycznego w pozycje ortoorto- i parapara- (powstają dwa izomery). Gdy zaś reakcję prowadzi się w warunkach sprzyjających tworzeniu wolnych rodników (światło, nadtlenki), to wówczas podstawieniu ulega atom wodoru w łańcuchu bocznym.
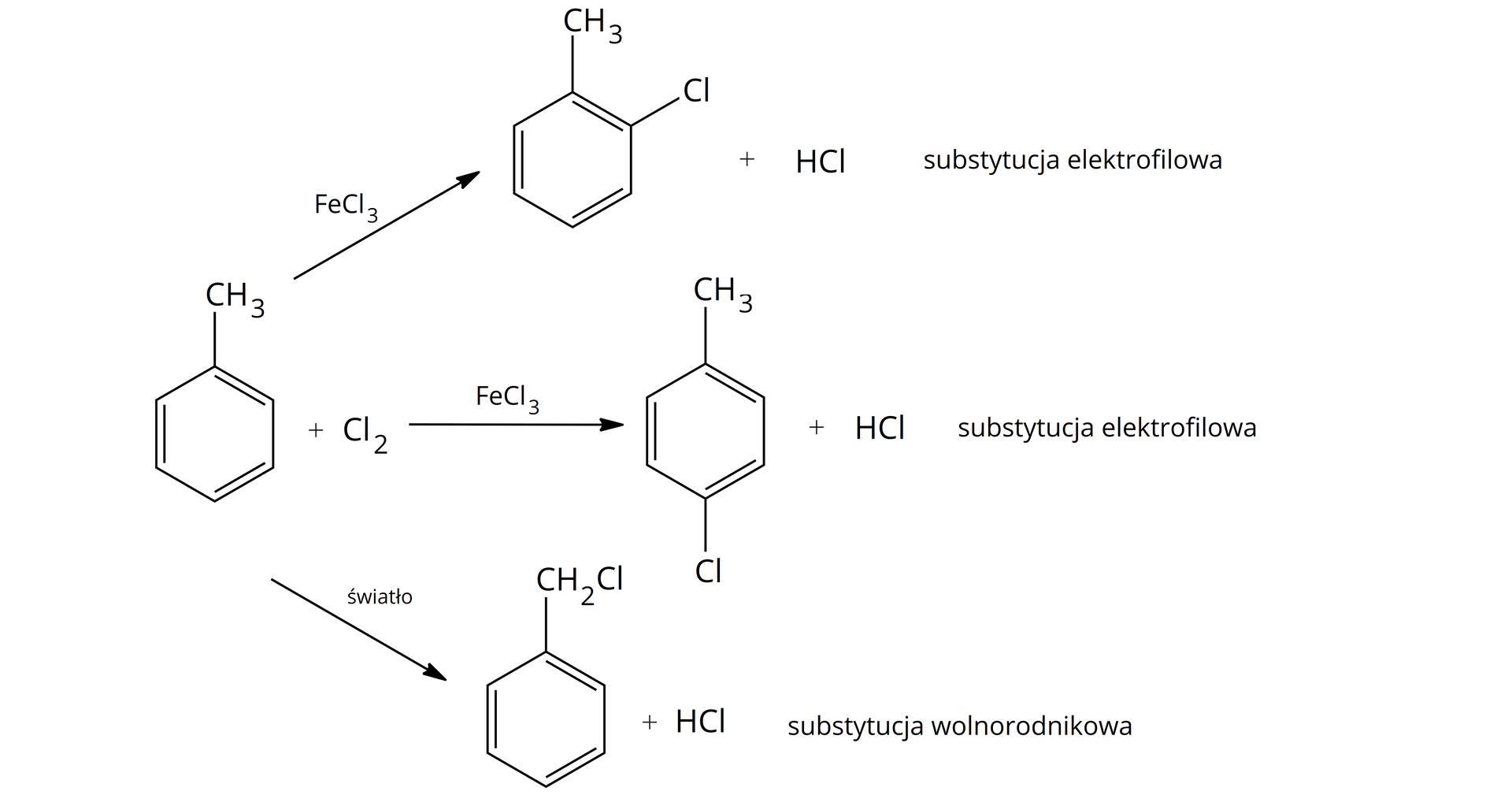
Chlorowanie benzenu w obecności światła
Benzen pod wpływem światła ultrafioletowego może ulec reakcji addycji do ,,,,,-heksachlorocykloheksanu. Reakcję tę po raz pierwszy przeprowadził Michael Faraday w roku:

,,,,,-heksachlorocykloheksan (lidan) jest powszechnie stosowany jako pestycyd, a także jako aktywny składnik preparatów do zwalczania szkodników, głównie w leśnictwie i w uprawach roślin przemysłowych. ,,,,,-heksachlorocykloheksan jest substancją krystaliczną o słabym zapachu stęchlizny. Wykazuje on właściwości owadobójcze, z tego powodu stosowano go do ochrony zielników przed owadami. W medycynie jest wykorzystywany jako lek do stosowania zewnętrznego przeciw wszawicy i świerzbowi.

Słownik
reakcja chemiczna polegająca na addycji (dodaniu), substytucji (podstawieniu) lub przegrupowaniu atomów pierwiastków z grupy fluorowców (halogenów) do cząsteczek związków organicznych, w wyniku czego powstają halogenopochodne
(dokładniej: aromatyczna substytucja elektrofilowa) reakcja substytucji zachodząca dla związków aromatycznych, w wyniku której dochodzi do wymiany atomu wodoru na reagent elektrofilowy; substytucja elektrofilowa jest oznaczana symbolem lub
wzajemne ułożenie podstawników w pierścieniu benzenowym w pozycji i
wzajemne ułożenie podstawników w pierścieniu benzenowym w pozycji i
kierują następny podstawnik w pozycje orto i para względem siebie oraz ułatwiają reakcję substytucji; podstawnikami -rodzaju są grupy: alkilowe, aminowe, alkoksylowe oraz grupa hydroksylowa; atomy chlorowców kierują kolejny podstawnik w pozycje orto i para, ale utrudniają jednocześnie reakcje podstawienia w pierścieniu aromatycznym
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.