Przeczytaj
Pręt lub płytka wykonana z metalu, zanurzona w wodzie lub roztworze soli, nazywana jest elektrodą. Z kolei elektroda z roztworem tworzą półogniwo, które zbudowane jest z przewodnika elektronowego, zanurzonego w przewodniku jonowym (najczęściej jest to roztwór odpowiedniego elektrolitu). Ponadto charakteryzuje się ono pewną cechą, nazywaną potencjałem standardowym.
Łącząc ze sobą dwa półogniwa o różnych potencjałach standardowych, możemy utworzyć jedno odpowiednie ogniwo. Pomiędzy elektrodami ogniwa istnieje mierzalna, przy pomocy woltomierzawoltomierza, różnica potencjałów, czyli napięcie ogniwa elektrycznego. Jednak nie ma takiej możliwości, by móc bezpośrednio zmierzyć potencjał pojedynczego półogniwa.
W związku z powyższym konieczne było wprowadzenie pewnej elektrody, której potencjał uznaje się za zerowy. W tym celu wykorzystuje się tzw. standardową elektrodę wodorową.
Standardowa elektroda wodorowa
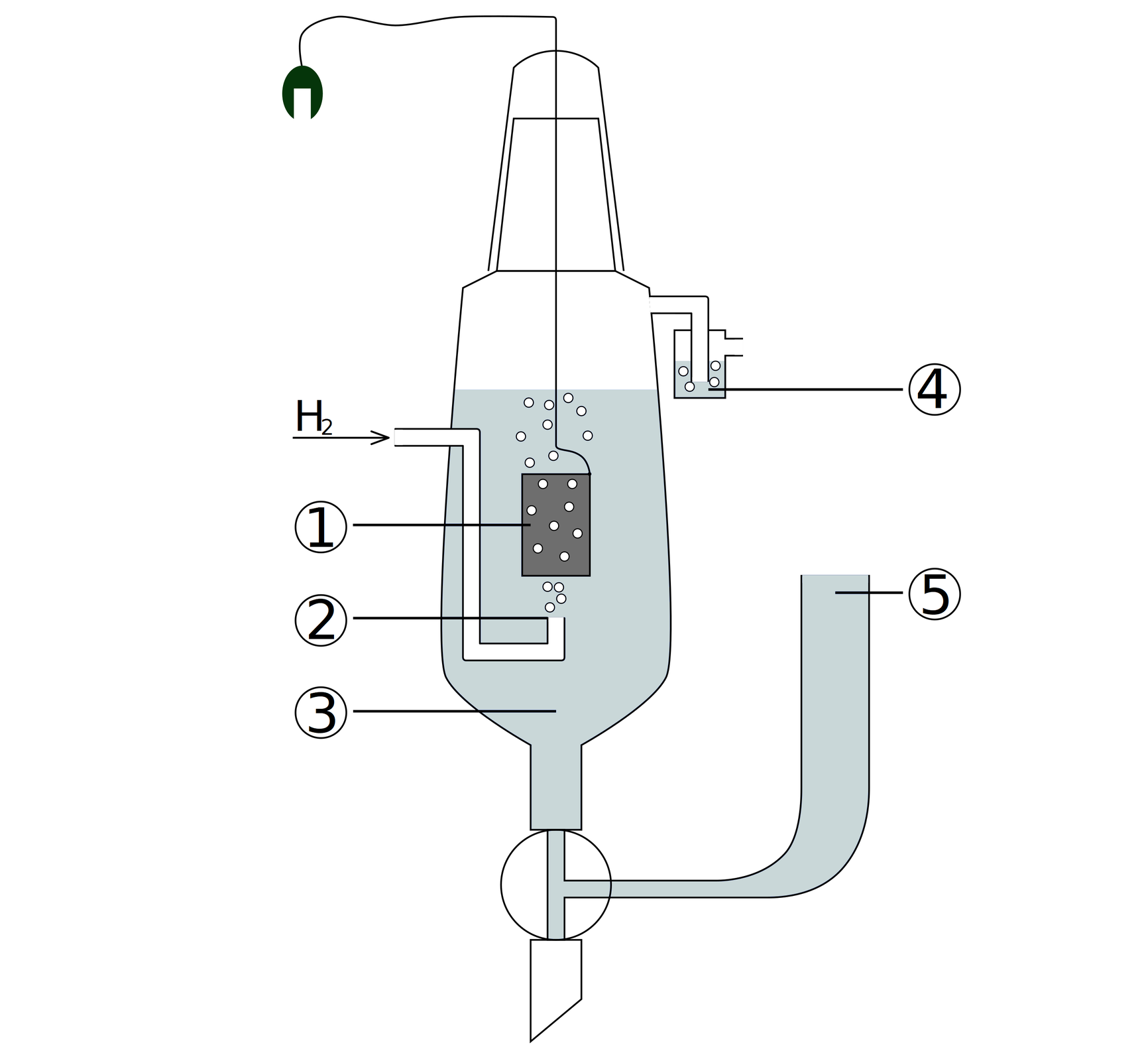
1 – blaszka platynowa pokryta czernią platynową
2 – rurka doprowadzająca pęcherzyki wodoru
3 – roztwór zawierający jony
4 – płuczka blokująca dostęp powietrza
5 – zbiornik z zapasem elektrolitu
Gazowy wodór nie może być elektrodą, a więc używa się do tego odpowiedniej konstrukcji. Półogniwo wodorowe zbudowane jest z płytki platynowej, pokrytej czernią platynowączernią platynową, zanurzoną w roztworze kwasu, w którym stężenie jonów jest równe . Taką płytkę omywa się gazowym wodorem pod ciśnieniem
1 atmosfery (1013 hPa).
To ze względu na swoją inertnośćinertność i odporność na działanie kwasów, do konstrukcji półogniwa wodorowego wykorzystuje się platynę. Aby zwiększyć powierzchnię całkowitą i absorpcję wodoru na powierzchni elektrody, płytkę platynową pokrywa się wspomnianą wcześniej czernią platynową.
Reakcję tego półogniwa można zapisać równaniem:
Korzystając z konwencji sztokholmskiejkonwencji sztokholmskiej, schemat powyższego półogniwa możemy zapisać jako:
Zgodnie z konwencją sztokholmską, definiujemy jako potencjał standardowy półogniwa siłę elektromotoryczną ogniwa (SEM) zbudowanego w ten sposób, że prawym półogniwem jest w nim rozważane półogniwo, a lewym - półogniwo wodorowe (określenia prawe i lewe półogniwo dotyczą zapisu ogniwa). Zgodnie z tym, SEM ogniwa zbudowanego z danych półogniw równa jest różnicy potencjałów standardowych półogniwa prawego (katody) i lewego (anody).
Z definicji potencjału półogniwa, standardowy potencjał półogniwa wodorowego równy jest zeru w każdej temperaturze. Każda elektroda metalowa (półogniwo), zanurzona w roztworze swojej soli, wykazuje charakterystyczne napięcie elektryczne w stosunku do elektrody wodorowej. Mierząc napięcie pomiędzy różnymi elektrodami zanurzonymi w jednomolowych roztworach swoich soli a elektrodą wodorową i odczytując wartość napięcia, możemy skonstruować szereg napięciowy metali :
Elektroda | Indeks dolny 0 Indeks dolny koniec0 [V] | Elektroda | Indeks dolny 00 [V] |
-3,04 | -0,26 | ||
-2,92 | -0,25 | ||
-2,91 | -0,14 | ||
-2,76 | -0,13 | ||
-2,71 | -0,04 | ||
-2,36 | 0,00 | ||
-1,70 | +0,34 | ||
-1,18 | +0,80 | ||
-0,76 | +0,85 | ||
-0,74 | +1,19 | ||
-0,44 | +1,50 |
Indeks górny Tabela 1. Potencjały standardowe Indeks dolny 0 Indeks dolny koniec0 metali. Opracowano na podstawie „Wybrane wzory i tabele fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki” Centralnej Komisji Egzaminacyjnej. Indeks górny koniecTabela 1. Potencjały standardowe Indeks dolny 0 Indeks dolny koniec0 metali. Opracowano na podstawie „Wybrane wzory i tabele fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki” Centralnej Komisji Egzaminacyjnej.
Wartości napięcia w powyższej tabeli są podane dla płytki metalu zanurzonego w roztworze swojej soli o stężeniu 1 , w temperaturze 25°C. Dodatnia wartość potencjału standardowego oznacza, że metal zanurzony w roztworze swojej soli o stężeniu 1 ma mniejszą zdolność do oddawania elektronów względem elektrody wodorowej. Wówczas elektrony gromadzą się na półogniwie wykonanym z danego metalu. Z kolei ujemna wartość oznacza większą zdolność do oddawania elektronów względem elektrody wodorowej. Wówczas elektrony gromadzą się na półogniwie wodorowym.
Słownik
przyrząd służący do pomiaru napięcia
drobno rozdrobniona platyna
bierność w określonych warunkach
konwencja zapisu ogniw, w której elektrodę ujemną zapisuje się po lewej stronie, a dodatnią po prawej
Bibliografia
Encyklopedia PWN
Pigoń K., Ruziewicz K., Chemia fizyczna, cz. 1, Warszawa 1986.
Sołtys Z., Chemia nieorganiczna dla techników chemicznych, Warszawa 1981.