Przeczytaj
Właściwości fizyczne kwasów karboksylowych
Kwasy karboksylowe to grupa związków o wzorze ogólnym: . Podstawnik R może być resztą węglowodorową, pochodzącą z węglowodoru nasyconego, nienasyconego lub grupy arylowej. Grupa jest grupą funkcyjną.
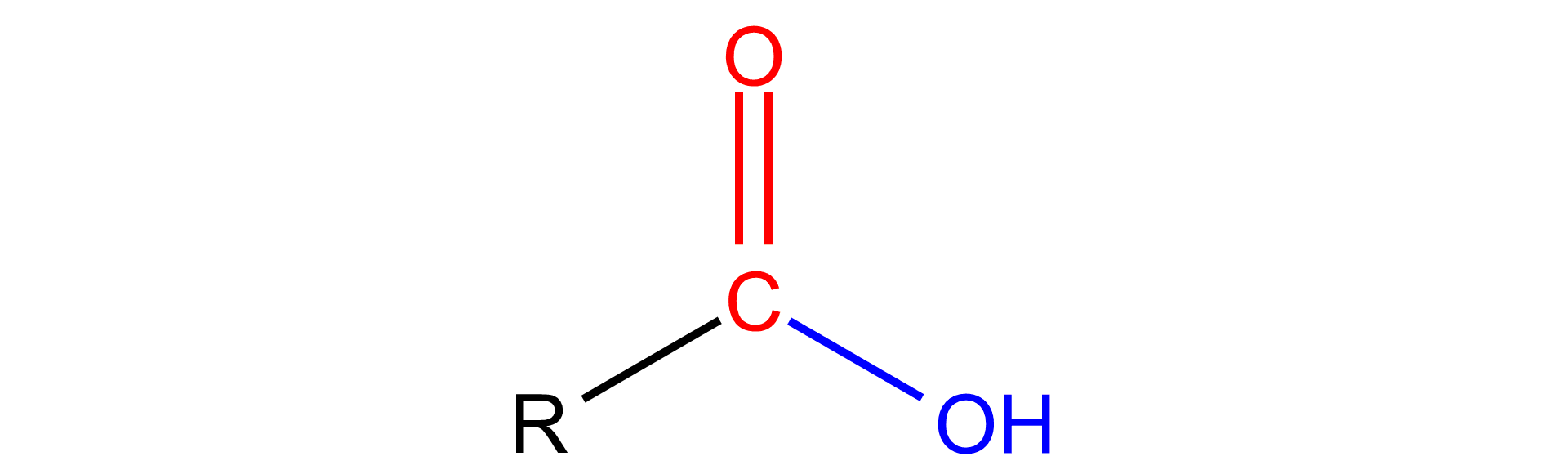
R – grupa alkilowa, arylowa bądź atom wodoru
Rozpuszczalność
W cząsteczkach kwasów karboksylowych występuje polarna grupa karboksylowa, w której skład wchodzi grupa karbonylowa () oraz hydroksylowa (). Obecność tych grup sprawia, że możliwe jest wytworzenie wiązania wodorowegowiązania wodorowego pomiędzy cząsteczkami kwasu. Obecność grupy hydroksylowej i karbonylowej wpływa na właściwości fizyczne kwasów karboksylowych. Grupa karbonylowa charakteryzuje się wysoką polarnością, dzięki czemu kwasy karboksylowe są silnie polarne. Dodatkowo atom wodoru, pochodzący z grupy karbonylowej, z łatwością tworzy wiązania wodorowe. Przypomnij sobie, że pierwszy z węglowodorów – metan () – w warunkach pokojowych jest gazem. Natomiast najprostszy kwas karboksylowy – kwas mrówkowy () – w warunkach pokojowych jest cieczą. Swój stan skupienia zawdzięcza właśnie występowaniu wiązania wodorowego, wytworzonego między cząsteczkami kwasu.
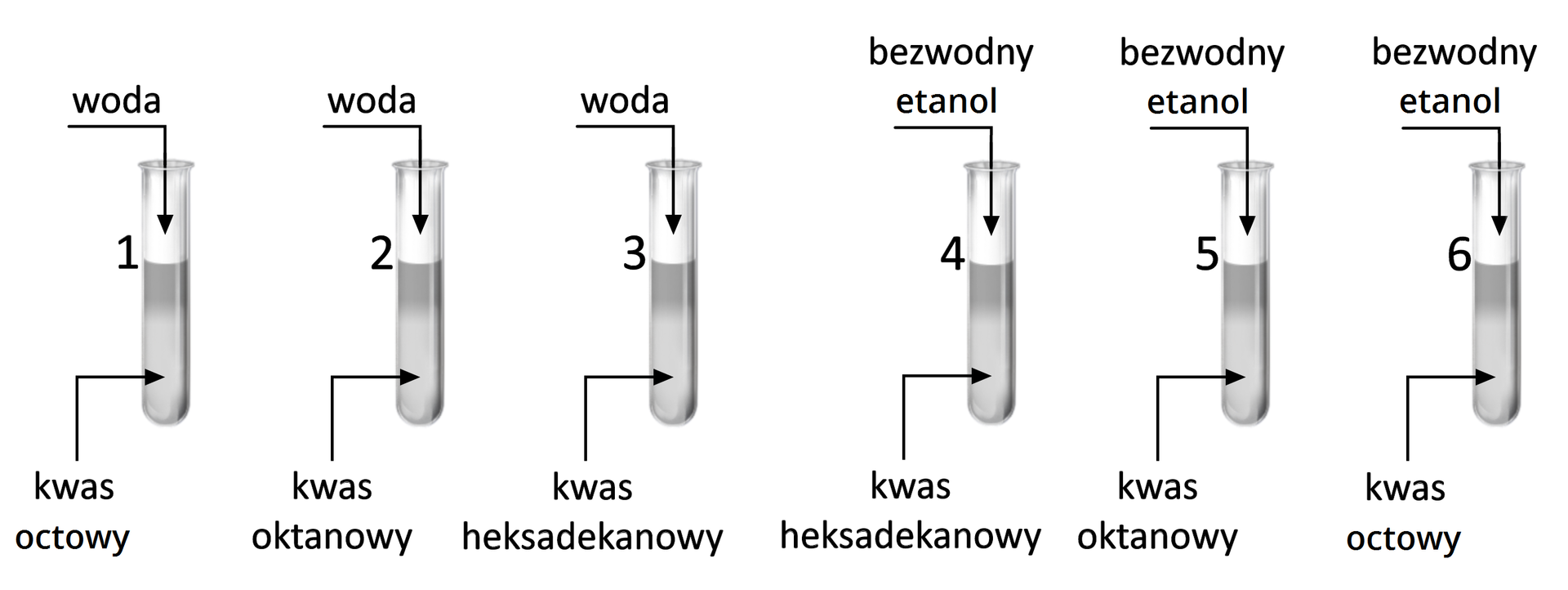
Kwasy karboksylowe wykazują lepszą rozpuszczalnośćrozpuszczalność w etanolu (lub innych rozpuszczalnikach organicznych) ze względu na możliwość wytworzenia wiązań wodorowych między grupą karbonylową cząsteczki kwasu a grupą hydroksylową cząsteczki alkoholu. Rozpuszczalność kwasów karboksylowych w wodzie jest spowodowana tworzeniem się wiązań wodorowych oraz oddziaływań dipol‑dipol pomiędzy polarnym fragmentem organicznej cząsteczki (kwasu) a wodą. Podobna sytuacja występuje w przypadku rozpuszczania alkoholi w wodzie. Rozpuszczalność kwasów karboksylowych zmniejsza się wraz ze wzrostem liczby atomów węgla w budowie kwasu.
Mając do dyspozycji kwas octowy (kwas etanowy), kwas oktanowy (kwas kaprylowy), kwas heksadekanowy (kwas palmitynowy), wodę, bezwodny alkohol etylowy, zaproponuj doświadczenie, w którym zbadasz zachowanie się kwasów względem rozpuszczalników: wody i etanolu. Porównaj stany skupienia kwasów. Zastanów się, co wpływa na stan skupienia.
Właściwości chemiczne kwasów karboksylowych
Kwasy organiczne są słabymi elektrolitami, co oznacza, że w roztworze wodnym nie wszystkie cząsteczki kwasu dysocjują na kationy hydroniowe () i aniony reszty kwasowej ().
W celu określenia mocy kwasu organicznego używa się stałej dysocjacjistałej dysocjacji kwasowej .
Wyrażenie na stałą dysocjacji kwasustałą dysocjacji kwasu:
- równowagowe stężenie molowe jonów hydroniowych ;
- równowagowe stężenie molowe jonów karboksylanowych ;
- równowagowe stężenie molowe kwasu karboksylowego .
Im wartość stałej dysocjacji kwasu większa, tym więcej cząsteczek kwasu ulega dysocjacjidysocjacji, w rezultacie pH roztworu maleje.
W doświadczeniu użyto roztworów następujących kwasów: kwas butanowy, kwas 2‑chlorobutanowy, kwas 3‑chlorobutanowy, kwas 4‑chlorobutanowy o takim samym stężeniu, czyli 1 . Następnie, za pomocą pH‑metru, zmierzono pH wszystkich roztworów. Odpowiedz na pytanie: jak wpływa położenie podstawnika (atom chloru) w stosunku do grupy funkcyjnej na pH roztworu? Zapisz przebieg doświadczenia.
Słownik
rodzaj oddziaływania międzycząsteczkowego lub wewnątrzcząsteczkowego za pośrednictwem atomu wodoru; w wiązaniu wodorowym, atom wodoru tworzy mostek łączący dwa elektroujemne atomy z jednym z nich połączony jest wiązaniem kowalencyjnym (wiązanie chemiczne), a z drugim siłami elektrostatycznymi. Aby powstało wiązanie wodorowe ważne, atomy oznaczone jako i muszą być bardziej elektroujemne niż atom wodoru – są to atomy posiadające wolną parę elektronową, np.: , ,
zdolność substancji do tworzenia z innymi substancjami układów jednorodnych (roztworów)
(gr. ḗlektron „bursztyn”; gr. lytós „rozpuszczalny”) roztwór, w którym znajdują się jony; przewodnik elektryczny jonowy, w którym poruszające się jony przenoszą ładunki elektryczne i przewodzenie prądu zawsze jest związane z transportem masy
stała równowagi wyrażona jako stosunek iloczynu stężeń jonów, powstających podczas dysocjacji elektrolitycznej do stężenia cząsteczek niezdysocjowanych, pozostających w równowadze chemicznej z jonami
proces rozpadu elektrolitów (kwasów, zasad, soli) pod wpływem rozpuszczalnika, najczęściej wody, na dodatnio i ujemnie naładowane cząstki, tj. jony
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.