Przeczytaj
Teoria kwasowo–zasadowa
Jedną z teorii kwasowo–zasadowych jest teoria Lewisateoria Lewisa, która bazuje na koncepcji wiązania koordynacyjnegowiązania koordynacyjnego (donorowo–akceptorowego), w celu określenia roli kwasu i zasady. Wiązania koordynacyjne to specjalne typy wiązań kowalencyjnych, nazywane wiązaniami donorowo–akceptorowymi, ponieważ para elektronowa, tworząca wiązanie, pochodzi tylko od jednego atomu – donoradonora. Przykładem reakcji, w czasie której powstaje wiązanie koordynacyjne, jest reakcja cząsteczki z jonem .
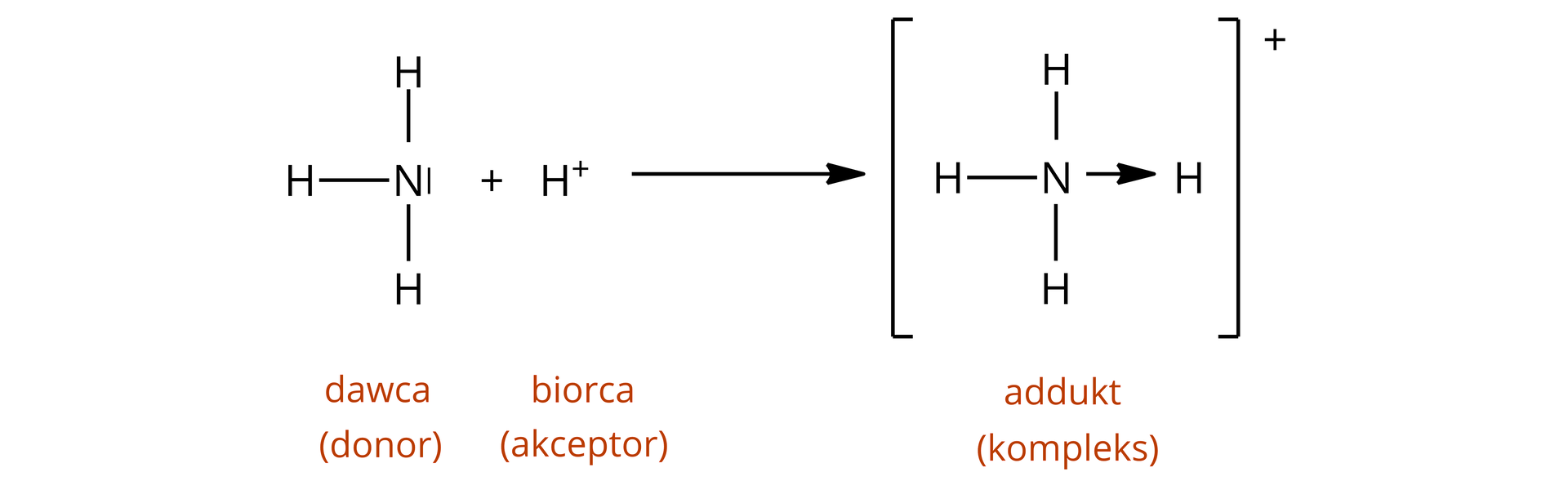
Według teorii Lewisa, zasady są donorami (dawcami) pary elektronowej, przekazują ją do akceptoraakceptora (kwasu Lewisa) w celu wspólnego używania. Konkludując – zasady są donorami (dawcami) pary elektronowej, a kwasy są jej akceptorami (biorcami). W reakcji kwasu z zasadą Lewisa powstaje kompleks. Jest to w chemii pojęcie dosyć szerokie, obejmujące m.in. związki koordynacyjnezwiązki koordynacyjne.
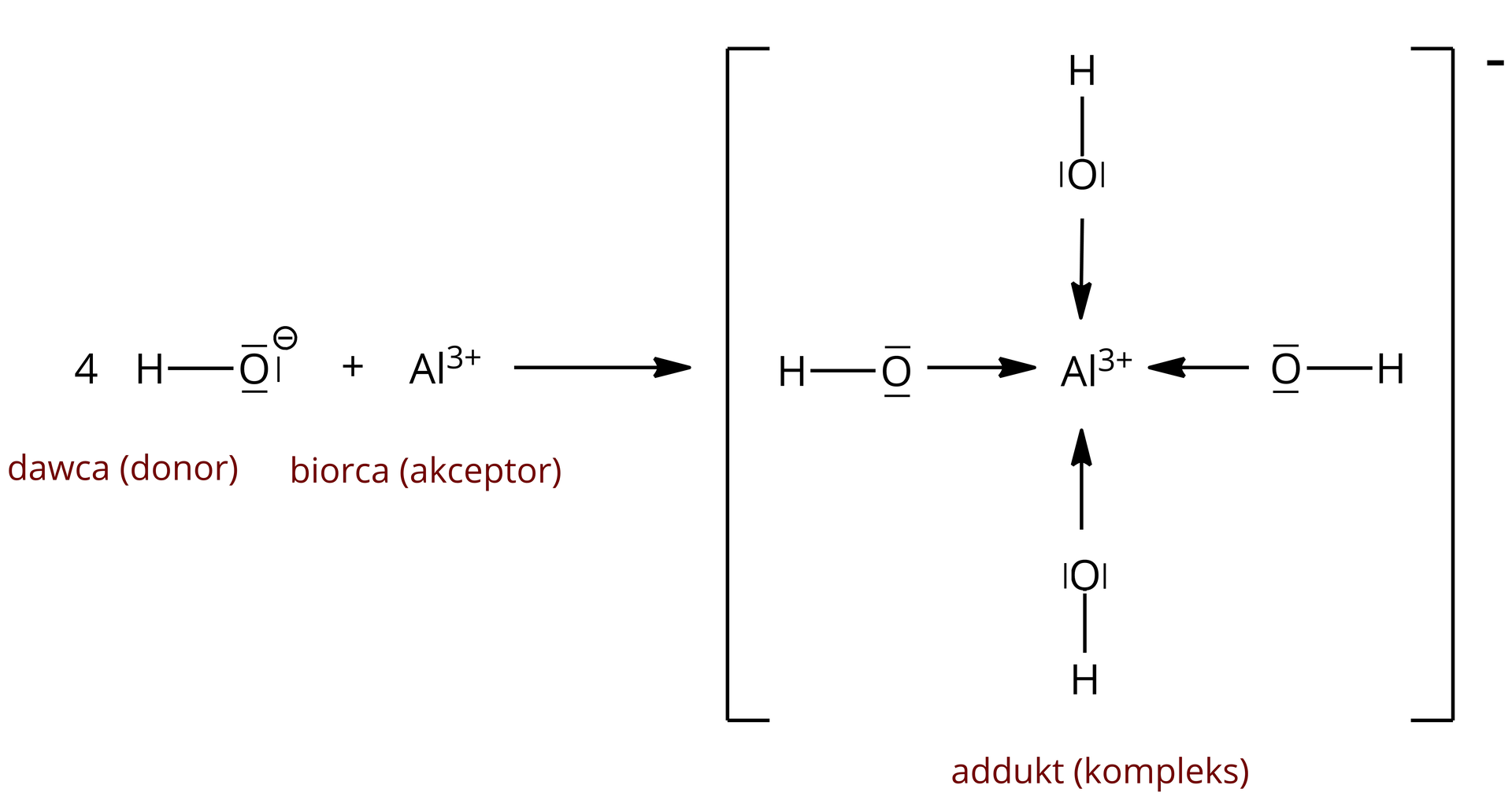
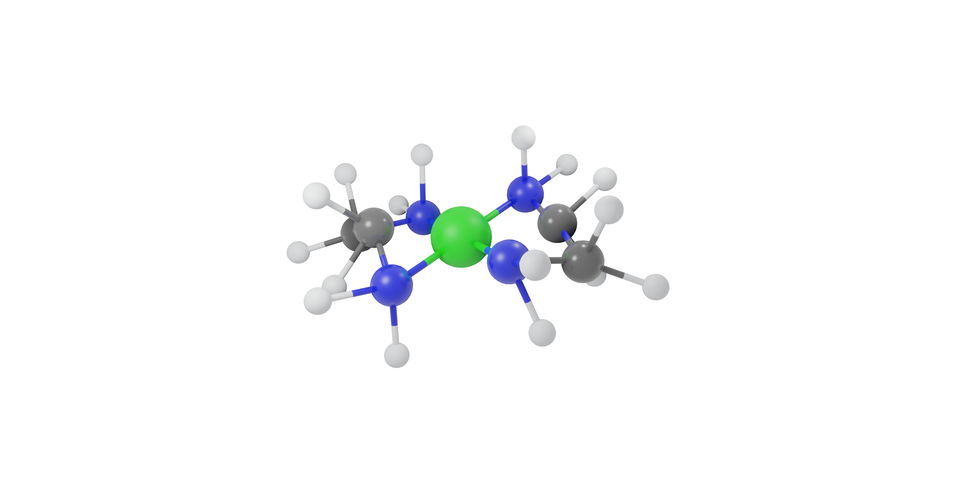
W przedstawionym anionie kompleksowym kation glinu jest atomem centralnym (jonem centralnym), natomiast jony pełnią funkcję ligandówligandów, a więc donorów par elektronowych, do tworzenia wiązań koordynacyjnych.
W przedstawionym przypadku kation glinu połączony jest z czterema anionami hydroksylowymi, zatem jego liczba koordynacyjna wynosi . Dlaczego akurat tyle jonów związało się z kationem glinu? Aby odpowiedzieć na to pytanie, należy zwrócić uwagę na konfigurację elektronów walencyjnych atomu glinu.
Atom glinu posiada trzy elektrony walencyjne na podpowłokach oraz . Zatem kation nie posiada na tych podpowłokach żadnego elektronu – są one zatem puste. Te puste podpowłoki mogą stać się akceptorami wolnych par elektronowych, pochodzących od jonów . Jako że łącznie te podpowłoki zbudowane są z orbitali: jednego orbitalu typu oraz trzech orbitali typu , stąd kation glinu może utworzyć cztery wiązania donorowo–akceptorowe, więc jego liczba koordynacyjna wynosi . Jest również możliwe, aby kation glinu posiadał liczbę koordynacyjną równą , np. w akwakompleksach – – w tym przypadku dochodzi do hybrydyzacji orbitali typu , oraz dwóch typu , w wyniku czego powstaje pustych orbitali o jednakowej energii.
Zapamiętaj!
Strzałka, która przedstawia wiązanie koordynacyjne, skierowana jest zawsze od zasady do kwasu Lewisa (w tym samym kierunku, w jakim została przekazana para elektronowa).
Ligand może istnieć niezależnie jako samodzielny jon lub cząsteczka.
Rodzaje ligandów
Aby dane indywiduum mogło pełnić rolę liganda, musi posiadać minimum jedną wolną parę elektronową. Stąd ligandy są obojętnymi cząsteczkami lub anionami. Nazwy ligandów anionowych zawsze kończą się na „o“, natomiast ligandy obojętne nie mają specjalnej końcówki.
Ligandy anionowe | Ligandy obojętne | ||
|---|---|---|---|
chloro bromo jodo hydrokso cyjano tiocyjaniano okso | akwa amina karbonyl nitrozyl | ||
Nazwy i wzory związków koordynacyjnych
Wzór ogólny jonu kompleksowego wygląda następująco:
gdzie:
– symbol ligandu;
– symbol jonu centralnego;
– liczba koordynacyjna jonu centralnego, jeśli jest więcej niż jeden typ ligandu, to ich suma jest równa liczbie koordynacyjnej;
– ładunek jonu kompleksowego.
Nazwy jonów tworzy się w następujący sposób:
Wymieniamy ligandy w kolejności alfabetycznej według ich nazw (w przypadku zapisywania, wzory wymienia się alfabetycznie według symboli).
Stosujemy liczebniki wielokrotne: di–, tri–, tetra–, itd. do określenia liczebności ligandów.
Stopień utlenienia atomu centralnego podajemy w postaci cyfry rzymskiej (z wyjątkiem zera, które zapisujemy cyfrą arabską), ujętej w nawiasach.
Obliczamy ładunek jonu:
jeśli ujemny – końcówka –an;
jeśli lub dodatni – brak koncówki.
- Nazwa liganda to "amina“
- Obecność sześciu ligandów jednego rodzaju zaznaczamy liczebnikiem "heksa“ "heksaamina“
- Jonem centralnym jest kobalt, cały kompleks jest obdarzony ładunkiem dodatnim, "kobalt“ - "heksaaminakobalt“ lub "kation heksaaminakobaltu“
- Ponieważ ligandy są obojętne, dlatego stopień utlenienia kobaltu równa się ładunkowi jonu i wynosi “III“
- Nazwa liganda to "chloro“
- Obecność czterech ligandów jednego rodzaju zaznaczamy liczebnikiem "tetra“ - "tetrachloro“
- Jonem centralnym jest miedź, cały kompleks jest obdarzony ładunkiem ujemnym, "miedzian“ - "tetrachloromiedzian" lub "anion tetrachloromiedzianowy“
- Ponieważ każdy ligand posiada ładunek 1-, dlatego stopień utlenienia miedzi równa wynosi “II“
- Wymieniamy ligandy w kolejności alfabetycznej
- w nazwie - wg nazw → "amina“ przed "chloro“
- we wzorze - wg symboli → Cl przed NH3
- Stosujemy liczebniki zwielokratniające: di, tri, tetra... - "pentaaminachloro“
- Jonem centralnym jest kobalt, ładunek dodatni - "pentaaminachlorokobalt“
- W kompleksie jest pięć ligandów obojętnych i jeden jednoujemny, ładunek kompleksu wynosi 2+, czyli jonem centralnym jest kobalt(III)
- Nazwa liganda to „amina”.
- Obecność sześciu ligandów jednego rodzaju zaznaczamy liczebnikiem „heksa-” – „heksaamina”.
- Jonem centralnym jest kobalt, a cały kompleks jest obdarzony ładunkiem dodatnim: jon heksaaminakobaltu.
- Ponieważ ligandy są obojętne, to stopień utlenienia kobaltu równa się ładunkowi jonu i wynosi „III”.
- Nazwa liganda to „chloro”.
- Obecność czterech ligandów jednego rodzaju zaznaczamy liczebnikiem „tetra-” – „tetrachloro”.
- Jonem centralnym jest miedź, a cały kompleks jest obdarzony ładunkiem ujemnym: anion tetrachloromiedzianowy.
- Ponieważ każdy ligand posiada ładunek 1-, a całkowity ładunek jonu wynosi 2-, dlatego ładunek jonu miedzi jest równy 2+, a stopień utlenienia miedzi wynosi „II”.
- Wymieniamy ligandy w kolejności alfabetycznej:
- w nazwie – wg nazw → „amina-“ przed „-chloro“;
- we wzorze – wg symboli → Cl przed NH3.
- Stosujemy liczebniki zwielokratniające: di-, tri-, tetra-... – „pentaaminachloro“.
- Jonem centralnym jest kobalt; ładunek dodatni: pentaaminachlorokobalt.
- W kompleksie jest pięć ligandów obojętnych i jeden jednoujemny; ładunek kompleksu wynosi 2+, czyli jonem centralnym jest kobalt(III).
Napisz wzory sumaryczne związków koordynacyjnych na podstawie ich nazwy.
Kation heksaakwamanganu().
Chlorek tetraaminamiedzi().
Tetrachloromiedzian() heksaakważelaza().
Budowa ligandów i kompleksów
Atom donorowy – atom, na którym znajduje się wolna para elektronowa, tworząca wiązanie koordynacyjne.
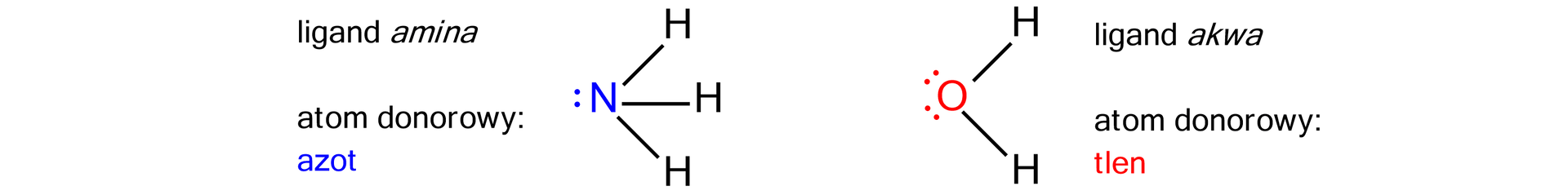
Liczba koordynacyjna – liczba atomów donorowych, koordynujących do jonu centralnego w kompleksie.
liczba koordynacyjna :
liczba koordynacyjna :
liczba koordynacyjna :
Ligandy i kompleksy chelatowe
Ligandy chelatowe – koordynują do jonu centralnego więcej niż jednym atomem donorowym.
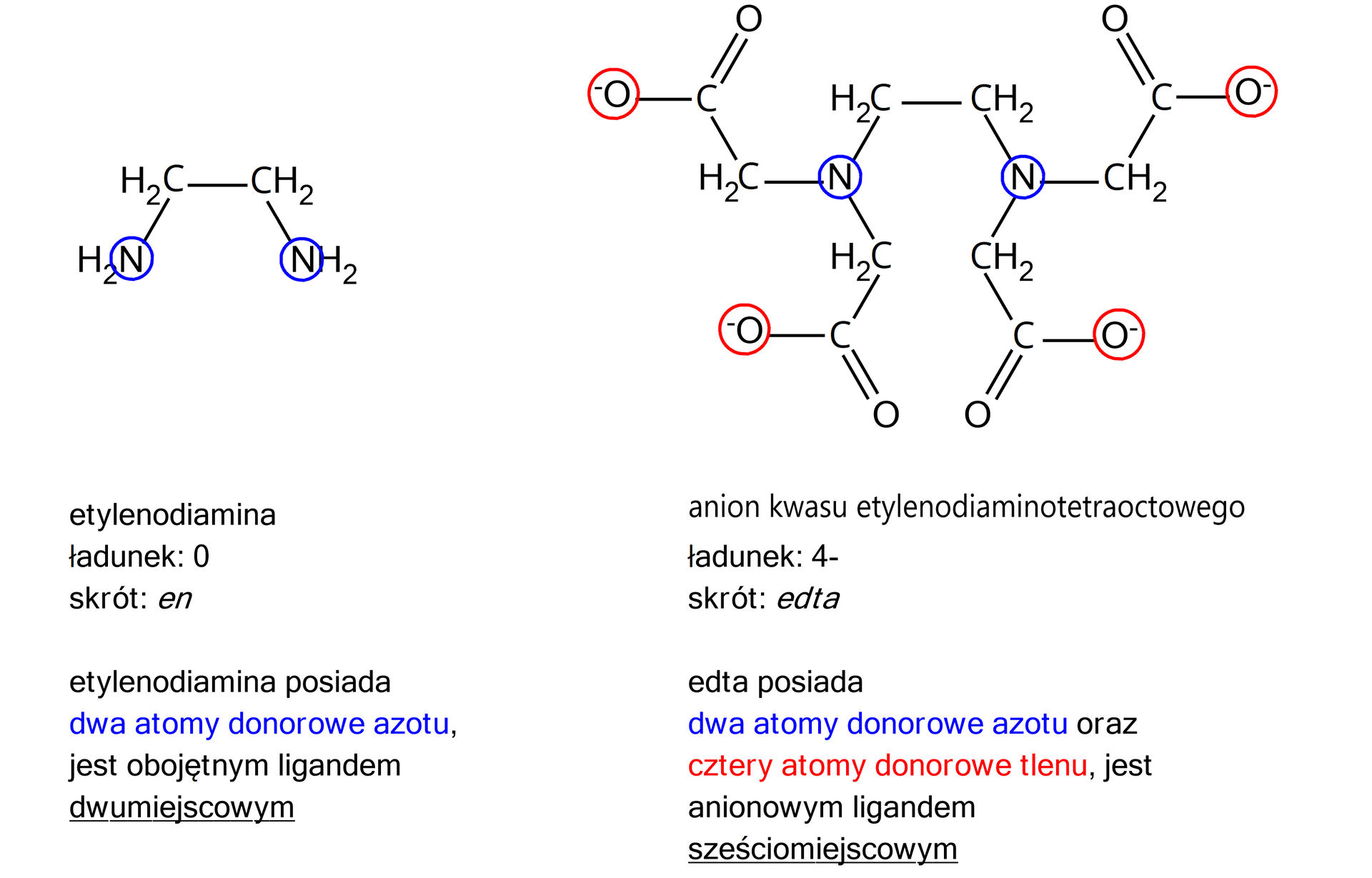
Kompleksy chelatowe – w nazwie kompleksu ujmujemy w nawiasy, stosujemy liczebniki: bis–, tris–, tetrakis–...; we wzorze stosujemy skróty.
Słownik
(łac. acceptor „ten, co przyjmuje”) w reakcjach chemicznych substancja złożona lub prosta (cząsteczka lub atom), przyjmująca protony, elektrony itp. od innej substancji
atom, cząsteczka lub jon, który ma zdolność przekazywania elektronu lub protonu innemu indywiduum chemicznemu
atom, jon lub cząsteczka, połączone wiązaniem koordynacyjnym z atomem centralnym
teoria, wg której kwasami są jony lub cząsteczki, które mają niedobór elektronów i mogą reagować z jonami lub cząsteczkami, zawierającymi wolne pary elektronowe
typ wiązania kowalencyjnego; wiązanie donorowo–akceptorowe; wiązanie chemiczne, które tworzy para elektronów, pochodząca od jednego atomu (donora) i wiążącego się z drugim atomem (akceptorem)
związki kompleksowe, kompleksy; złożone cząsteczki lub jony (kationy, aniony), w których atom (lub jon), zwany atomem (jonem) centralnym, jest połączony za pomocą wiązania koordynacyjnego z ligandami — jonami lub cząsteczkami obojętnymi
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa i wyd. następne.