Przeczytaj
Reakcja kwasów karboksylowych z metalami
Rozpuszczalne w wodzie kwasy karboksylowe reagują z niektórymi metalami, a w wyniku reakcji powstają sole (karboksylany) oraz wodór. Równanie reakcji możemy opisać w sposób ogólny:
Przykładowo, w wyniku reakcji pomiędzy magnezem a kwasem octowym powstaje octan (etanian) magnezu oraz wodór. Równanie reakcji chemicznej w zapisie cząsteczkowym wygląda następująco:
Reakcja kwasów karboksylowych z tlenkami metali
Przeanalizuj przebieg poniższego doświadczenia, zapisz obserwacje oraz wnioski.
Instrukcja:
1. Do probówki wprowadź około 3 roztworu kwasu etanowego.
2. Do probówki wsyp szczyptę tlenku miedzi(II) i zamieszaj.
3. Ogrzewaj probówkę.
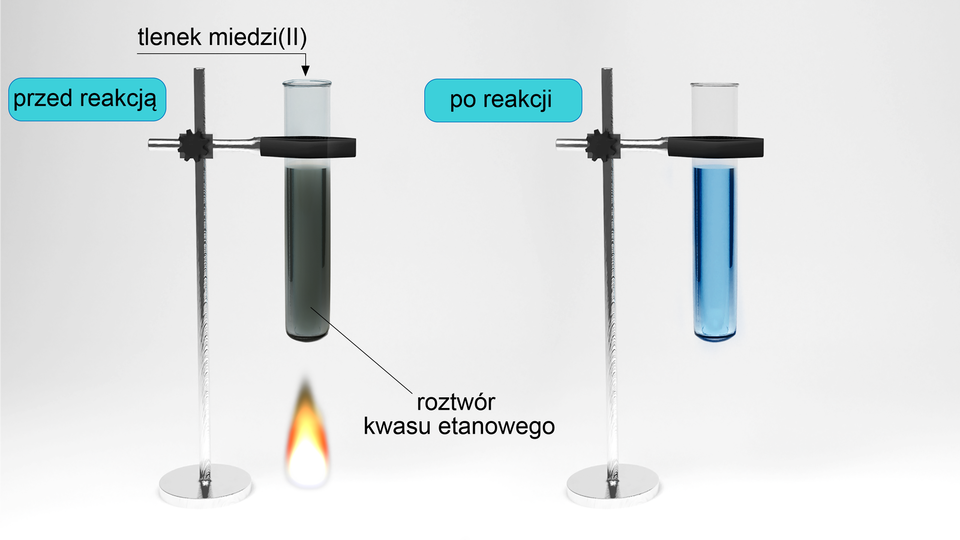
Wnioski:
Skorzystaj z powyżej metody i zapisz równanie reakcji w formie cząsteczkowej, w której powstaje mrówczan potasu.
Reakcja kwasów karboksylowych z wodorotlenkami metali
Rozpuszczalne w wodzie kwasy karboksylowe reagują z niektórymi wodorotlenkami metali. Ogólne równanie reakcji możemy zapisać w sposób ogólny:
Poniżej przedstawiono równanie reakcji pomiędzy wodorotlenkiem potasu a kwasem mrówkowym, w wyniku której powstaje mrówczan (metanian) potasu oraz woda.
Zapis cząsteczkowy:
Wyższe kwasy karboksyloweWyższe kwasy karboksylowe (tzw. kwasy tłuszczowe) również ulegają reakcjom z wodorotlenkami metali. W wyniku reakcji powstają sole kwasów tłuszczowych oraz woda.
Poniżej przedstawiono równanie reakcji pomiędzy wodorotlenkiem sodu a kwasem heksadekanowym (palmitynowym), w wyniku której powstaje heksadekanian (palmitynian) sodu oraz woda.
Zapis cząsteczkowy:
Na podstawie podanych poniżej informacji (problemu badawczego, instrukcji oraz wykazu sprzętu i odczynników) przedstaw hipotezę, przewidywane obserwacje oraz wnioski.
1. Do parownicy wprowadź około 3 stężonego roztworu wodorotlenku sodu.
2. Do parownicy dodawaj małymi porcjami kwas stearynowy, ciągle mieszając, a parowniczkę z zawartością ogrzewaj.

Wnioski:
Reakcja kwasów karboksylowych z solami słabszych kwasów
Analiza wartości stałych dysocjacjistałych dysocjacji kwasu karboksylowego () pozwala porównać ich moc.
Tabela 1. Wielkości stałej dysocjacji () wybranych kwasów odnotowane w temperaturze (z wyjątkiem kwasu metanowego ()).
Wzór kwasu | Nazwa zalecana przez IUPAC | Inna nazwa | Stała dysocjacji lub |
|---|---|---|---|
kwas węglowy | - | ||
kwas mrówkowy | kwas metanowy | ||
kwas octowy | kwas etanowy |
to stała dysocjacji kwasu wieloprotonowego dla pierwszego etapu dysocjacji, tu dla kwasu węglowego
Na podstawie analizy wartości stałych dysocjacji kwasów karboksylowych oraz kwasu węglowego możemy stwierdzić, że kwasy: mrówkowy i octowy są mocniejsze niż kwas węglowy.
Reakcja kwasu z solą innego słabszego kwasu pozwala udowodnić, że reagujący kwas jest mocniejszy. Równanie reakcji możemy opisać w sposób ogólny:
Podsumowanie
- Nazwa kategorii: Sole kwasów karboksylowych mogą powstać w reakcji kwasów karboksylowych z:
- Nazwa kategorii: metalami
- Nazwa kategorii: tlenkami metali
- Nazwa kategorii: wodorotlenkami metali
- Nazwa kategorii: solami słabszych kwasów Koniec elementów należących do kategorii Sole kwasów karboksylowych mogą powstać w reakcji kwasów karboksylowych z:
- Elementy należące do kategorii Sole kwasów karboksylowych mogą powstać w reakcji kwasów karboksylowych z:
-
Sole kwasów karboksylowych mogą powstać w reakcji kwasów karboksylowych z:
-
metalami
-
tlenkami metali
-
wodorotlenkami metali
-
solami słabszych kwasów
-
Słownik
związek organiczny, którego cząsteczka zawiera grupę funkcyjną karboksylową oraz długi łańcuch węglowodorowy (kilkanaście atomów węgla w cząsteczce); jest naturalnym składnikiem tłuszczy
stała równowagi chemicznej; stała procesu dysocjacji elektrolitycznej; jest charakterystyczna dla danego elektrolitu, a jej wartość jest bezwymiarowa
Bibliografia
Bobrański B., Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla Liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2003.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
McMurry J., Chemia organiczna 4, Warszawa 2004.
McMurry J., Chemia organiczna 3, Warszawa 2003.
Pazdro K. M., Rola‑Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.