Przeczytaj
Sulfan jest związkiem chemicznym, powszechnie znanym pod nazwą siarkowodór, o wzorze sumarycznym . Należy do wodorków grupy układu okresowego.
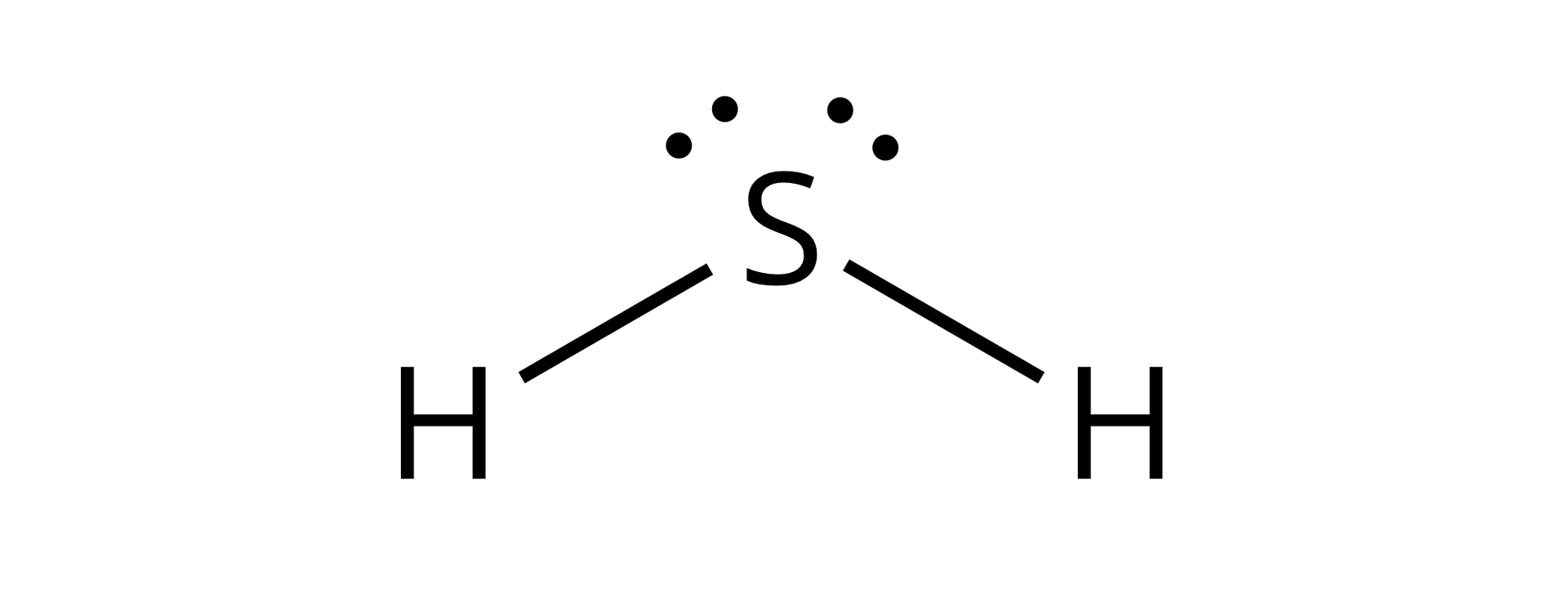
Atomem centralnymAtomem centralnym w cząsteczce sulfanu jest atom siarki, który jest połączony wiązaniem kowalencyjnym z dwoma atomami wodoru. Typ hybrydyzacjihybrydyzacji orbitali walencyjnych atomu siarki w sulfanie to .
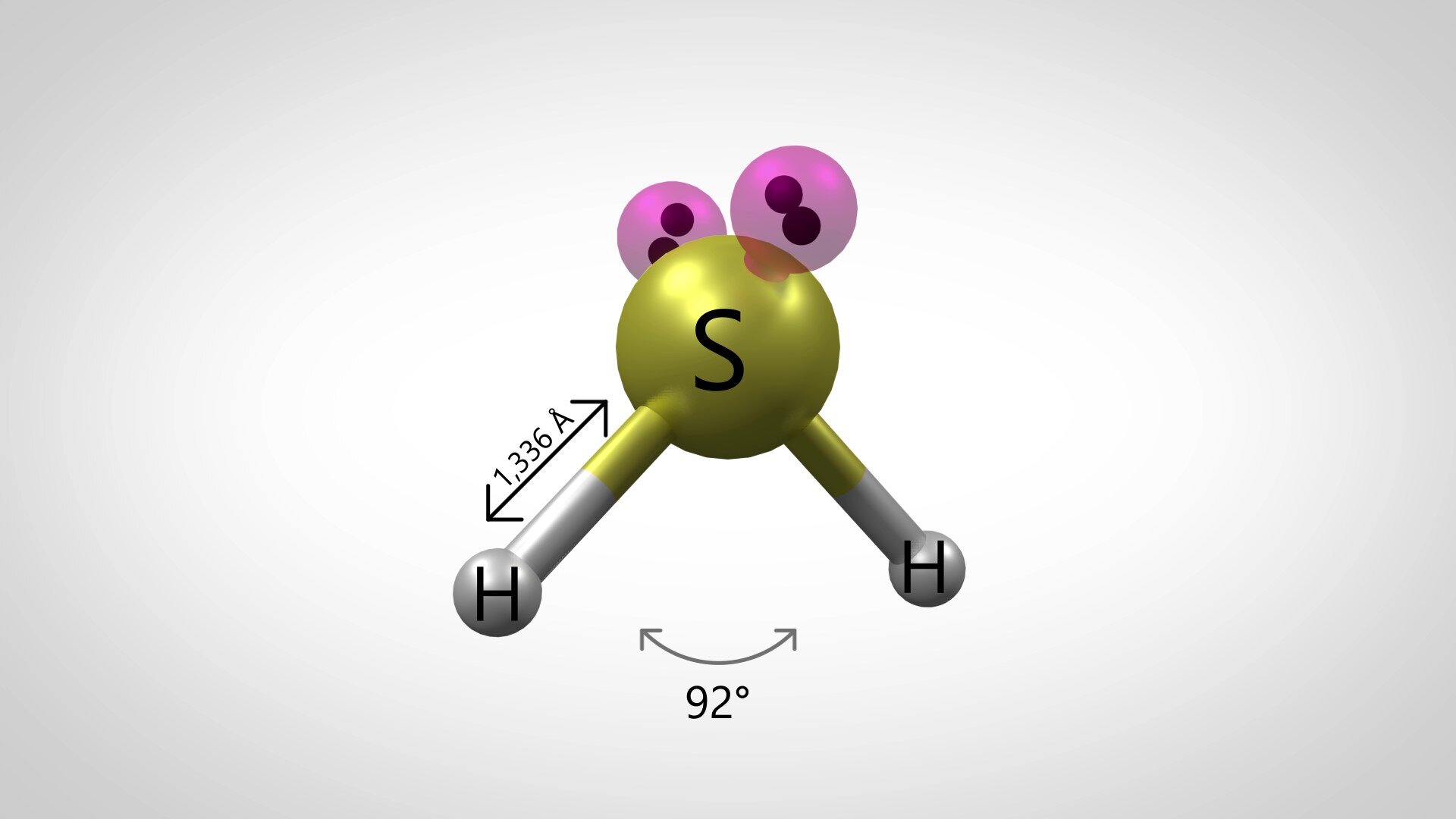
W cząsteczce sulfanu kąt pomiędzy wiązaniami wynosi , co świadczy o jej budowie kątowej. Taka wartość wynika z silnego odpychania się wolnych par elektronowych, które znajdują się na atomie siarki.
Wartość elektroujemnościelektroujemności atomu siarki wg skali Paulinga wynosi , a atomu wodoru . To oznacza więc, że różnica wartości elektroujemności tych atomów wynosi , co świadczy o występowaniu wiązania kowalencyjnego spolaryzowanego w cząsteczce sulfanu. Natomiast elektrony, biorące udział w tworzeniu wiązania chemicznego, są mocniej przyciągane przez atom siarki niż przez atomy wodoru. Jednak ładunek elektryczny w tej cząsteczce jest rozłożony bardziej równomiernie, niż ma to miejsce chociażby w przypadku cząsteczki wody. Wynikiem tego jest mała wartość momentu dipolowegomomentu dipolowego cząsteczki sulfanu, która wynosi i jest ona dwukrotnie mniejsza od wartości momentu dipolowego cząsteczki wody.
Siarkowodór w porównaniu z wodą nie tworzy silnych wiązań wodorowychwiązań wodorowych pomiędzy swoimi cząsteczkami, ponieważ nie zawiera silnie elektroujemnego atomu. Stąd właśnie jego niskie wartości temperatur wrzenia i topnienia. Sulfan topnieje w , a wrze w temperaturze .
Słownik
atom bądź jon, stanowiący rdzeń związku i przyłączający (lub koordynujący) pewną liczbę jonów lub atomów, zwanymi jonami lub atomami otaczającymi
(łac. orbita „koleina”, „droga”) funkcja falowa psi opisująca stan jednego elektronu, zależna od współrzędnych określających jego położenie w atomie (orbital atomowy), cząsteczce (orbital molekularny, orbital cząsteczkowy)
(łac. hybrida „krzyżówka”, „mieszaniec”) matematyczny zabieg, pozwalający na otrzymanie mieszanych orbitali elektronowych za pomocą linowych kombinacji wybranych funkcji falowych
zdolność atomów do przyciągania elektronów
inaczej moment dipolowy cząsteczki, wielkość wektorowa charakteryzująca, opisująca rozkład ładunku elektrycznego w cząsteczce związku
rodzaj oddziaływania międzycząsteczkowego; w wiązaniu wodorowym atom wodoru tworzy mostek łączący dwa elektroujemne (elektroujemność) atomy ; z jednym z nich () połączony jest wiązaniem kowalencyjnym spolaryzowanym (wiązanie chemiczne), a z drugim – siłami elektrostatycznymi
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Warszawa .
Bielański A., Podstawy chemii nieorganicznej, Warszawa .
Cotton F. A., Wilkinson G., Gaus P. L., Chemia nieorganiczna. Podstawy, Warszawa .
Encyklopedia PWN
Karta Charakterystyki. Siarkowodór, online: https://www.linde‑gaz.pl/pl/images/10021749_tcm48‑272361.pdf, dostęp: .