Przeczytaj
Wprowadzenie do analizy objętościowej
Analiza ilościowa jest metodą, za pomocą której chemicy są w stanie określić ilości oraz stężenia substancji obecnych w próbce, np. zawartość kwasu askorbinowego (witaminy C) w tabletce. Jednym z rodzajów analizy ilościowej jest analiza miareczkowa (objętościowa). Podczas analizy miareczkowej do określonej objętości roztworu z oznaczoną substancją (analitemanalitem) dodawany jest porcjami roztwór z biurety, zwany titrantemtitrantem, który jest roztworem mianowanymroztworem mianowanym.
Zapoznaj się z poniższą grafiką interaktywną, przedstawiającą zestaw do miareczkowania, i odpowiedz na pytania.
Biurety, stosowane do miareczkowania, często charakteryzują się odwrotną skalą, tzn. wartość „” jest na górze biurety, a na samym dole jest największa wartość, jednocześnie stanowiąca objętość biurety. Wyjaśnij, dlaczego zastosowanie takiej skali w biurecie do miareczkowania jest wygodniejsze od standardowej skali?
Miareczkowanie alkacymetryczne
Z uwagi na typ reakcji zachodzącej pomiędzy oznaczanym składnikiem a titrantemtitrantem, analiza miareczkowa jest podzielona na określone działy. Jednym z nich jest alkacymetriaalkacymetria oparta na reakcji zobojętniania, czyli reakcji kwasu z zasadą:
W zależności od rodzaju używanego titranta, alkacymetria obejmuje dwie metody oznaczeń:
alkalimetrięalkalimetrię – titrantem jest zasada, a analitem kwas;
acydymetrięacydymetrię – titrantem jest kwas, a analitem zasada.
Objętość zużytego podczas miareczkowania titranta pozwala na obliczenie zawartości składnika w badanej próbce. Miareczkowanie powinno zostać zakończone w momencie, gdy titrant przereaguje ilościowo z oznaczanym składnikiem. Moment ten definiuje się jako punkt równoważnikowypunkt równoważnikowy (PR), a do jego określenia stosowane są metody instrumentalne (np. pehametr) lub wizulane (wskaźnik chemiczny).
Wskaźniki chemiczne
Aby wizualnie określić koniec miareczkowania alkacymetrycznego, stosuje się odpowiedni wskaźnikwskaźnik (indykator), który zmienia barwę roztworu w okolicach zakończenia reakcji pomiędzy roztworem miareczkowanym a titrantem. Do analitu dodawana jest zazwyczaj niewielka ilość wskaźnika. Jeśli zostanie użyta duża ilość, wskaźnik wpłynie na końcowe , obniżając dokładność eksperymentu.
Moment, w którym wskaźnik zmienia barwę, nazywa się punktem końcowym miareczkowania (PK). Punkt ten zasadniczo powinien pokrywać się z punktem równoważnikowym, jednak w praktyce prawie zawsze następuje przed lub po nim. Różnica między punktem końcowym a punktem równoważnikowym nazywa się błędem miareczkowania.
Indeks dolny /Źródło: Lipiec T., Szmal Z., Chemia analityczna z elementami analizy instrumentalnej, Warszawa 1980./ Indeks dolny koniec/Źródło: Lipiec T., Szmal Z., Chemia analityczna z elementami analizy instrumentalnej, Warszawa 1980./

Wskaźniki kwasowo–zasadowe zmieniają barwę w różnych zakresach . Zakres zmiany barwy wskaźnika powinien leżeć w zakresie skoku miareczkowania, czyli gwałtownej zmiany w pobliżu punktu równoważnikowego.
Nazwa wskaźnika | Zakres zmiany barwy | Barwa wskaźnika poniżej niższej wartości | Barwa wskaźnika powyżej wyższej wartości |
|---|---|---|---|
oranż metylowy | – | czerwona | żółtopomarańczowa |
tymoloftaleina | – | bezbarwna | niebieska |
fenoloftaleina | – | bezbarwna | malinowa |
Błękit tymolowy | – | czerwona | żółta |
– | żółta | niebieska | |
błękit bromotymolowy | – | żółta | niebieska |
błękit bromofenolowy | – | żołta | niebieskofioletowa |
czerwień metylowa | – | czerwona | żółta |
czerwień Kongo | – | niebieska | czerwona |
lakmus | – | czerwona | niebieska |
Krzywe miareczkowania alkacymetrycznego
Krzywa miareczkowaniaKrzywa miareczkowania dla miareczkowania kwasowo‑zasadowego jest wykresem zależności analizowanego roztworu od objętości dodanego titranta. Oznacza to, że w miarę dodawania titranta z biurety zmienia się roztworu analizowanego. Krzywe te są przydatne przy wyborze odpowiednich wskaźników kwasowo‑zasadowych, które pozwalają na dokładne określenie punktów końcowychpunktów końcowych miareczkowania. Z uwagi na stosowanie słabych, jak i mocnych elektrolitówmocnych elektrolitów (kwasów oraz zasad), w alkacymetrii możliwe są cztery przypadki. W każdym z nich obserwuje się inny kształt krzywej miareczkowania.
Kształt krzywych w przypadku słabych elektrolitów zależy w znacznym stopniu od ich mocy – roztworów słabych elektrolitów zależy od stężenia i stałej dysocjacji, a w konsekwencji wpływa to również na profil krzywej miareczkowania oraz położenie punktu równoważnikowego.
Przykładowe krzywe miareczkowania dla różnych typów badanych roztworów przedstawiono poniżej.
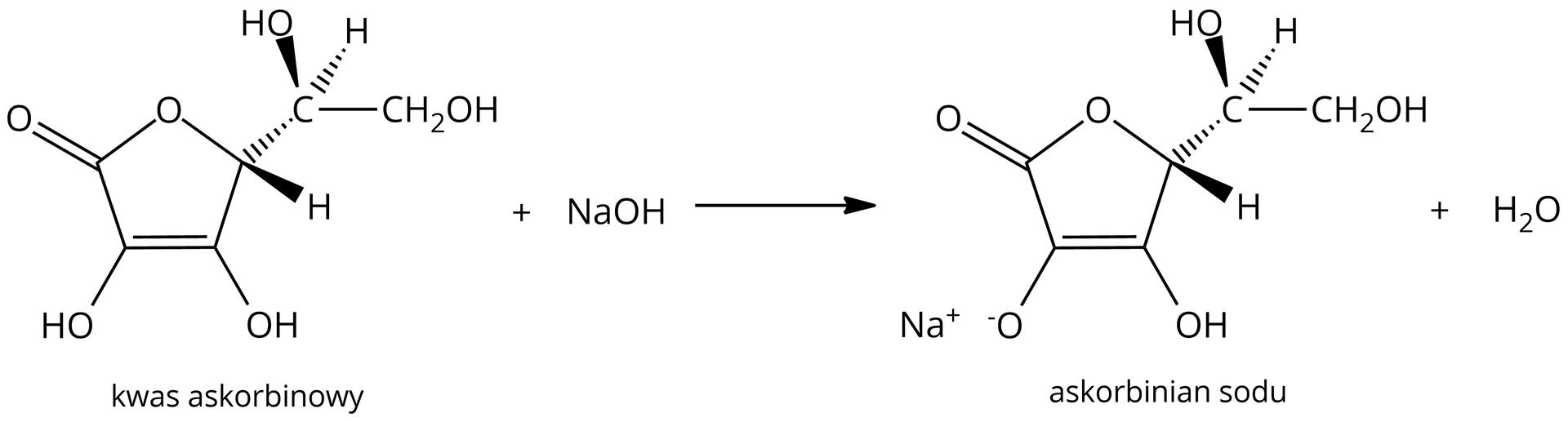
Jak obliczyć rzeczywistą masę kwasu askorbinowego w tabletce?
W laboratorium wykonano doświadczenie, w którym sprawdzano rzeczywistą zawartość kwasu askorbinowego w tabletce, komercyjnie dostępnego suplementu.
Na opakowaniu suplementu widnieje informacja, że tabletka zawiera kwasu askorbinowego.
Po rozpuszczeniu tabletki w wody destylowanej, do roztworu dodano niewielką ilość wskaźnika kwasowo‑zasadowego (błękitu bromotylowego).
Jak obliczyć rzeczywistą masę kwasu askorbinowego w tabletce, wiedząc, że jego masa molowa wynosi ?
Słownik
roztwór o ściśle określonym stężeniu molowym, podanym z dokładnością do czwartego miejsca po przecinku
roztwór miareczkujący o dokładnie znanym stężeniu
substancja, składnik oznaczany w próbce analitycznej
(łac. dissociatio „rozdzielenie”) samorzutny proces rozpadu drobin elektrolitów (kwasów, zasad, soli) w roztworach, na dodatnio i ujemnie naładowane cząstki, tj. jony, pod wpływem działania rozpuszczalnika
(gr. élektron „bursztyn”, lytós „rozpuszczalny”) związek, który w roztworze wodnym dysocjuje całkowicie na jony
punkt miareczkowania, w którym została doprowadzona taka ilość titranta, która jest równoważna chemicznie ilości substancji oznaczanej; punkt równoważnikowy wyznaczany jest w oparciu o stechiometrię reakcji zachodzącej pomiędzy titrantem a analitem
punkt, w którym nastąpiła wyraźna zmiana jakiejś cechy układu, wskazująca na całkowite przereagowanie składników titranta i analitu – w miareczkowaniu alkacymetrycznym jest to zwykle zmiana barwy roztworu związana z obecnością wskaźników kwasowo‑zasadowych
dział analizy ilościowej oparty o reakcje typu kwas‑zasada
(ar. al‑kali „substancja zasadowa”, gr. metréō „mierzę”) oznaczanie zawartości kwasów w roztworze za pomocą miareczkowania mianowanym roztworem zasady
(łac. acidus „kwaśny”, gr. metréō „mierzę”) oznaczanie ilości zawartych w badanym roztworze zasad za pomocą miareczkowania mianowanym roztworem kwasu
indykator; chemiczna substancja, która w określonych warunkach wykazuje wyraźną zmianę właściwości fizycznych – najczęściej pojawienie się lub modyfikację zabarwienia, co pozwala na stwierdzenie odczynu badanego roztworu albo obecności określonego jonu lub cząsteczki; wskażniki pH zmieniają swoją barwę przy określonym pH (np. fenoloftaleina)
graficzny sposób przedstawienia przebiegu procesu miareczkowania
Bibliografia
Encyklopedia PWN
Galus Z., Ćwiczenia rachunkowe z chemii analitycznej, Warszawa 2007, wyd. 9.
Lipiec T., Szmal Z., Chemia analityczna z elementami analizy instrumentalnej, Warszawa 1980.
Minczewski J., Marczenko Z., Chemia analityczna. T. 2. Chemiczne metody analizy ilościowej, Warszawa 2011, wyd. 10.
Persona A., Chemia analityczna, Warszawa 2007.
Rubel S., Pracownia Chemiczna. Analiza ilościowa, Warszawa 1999.