Przeczytaj
Funkcje tRNA
Proces ekspresji genu zachodzi zarówno w jądrze komórkowym, jak i w cytoplazmie. W jądrze komórkowym odbywa się transkrypcjatranskrypcja. Poza matrycą i rybosomami do biosyntezy białka niezbędna jest obecność transportującego kwasu rybonukleinowego (tRNA), który przenosi aminokwasy do nowo syntetyzowanego polipeptydu.
Cząsteczka tRNA jest łącznikiem między mRNA a aminokwasami tworzącymi polipeptyd. Ma formę przypominającą liść koniczyny złożoną z czterech pętli.
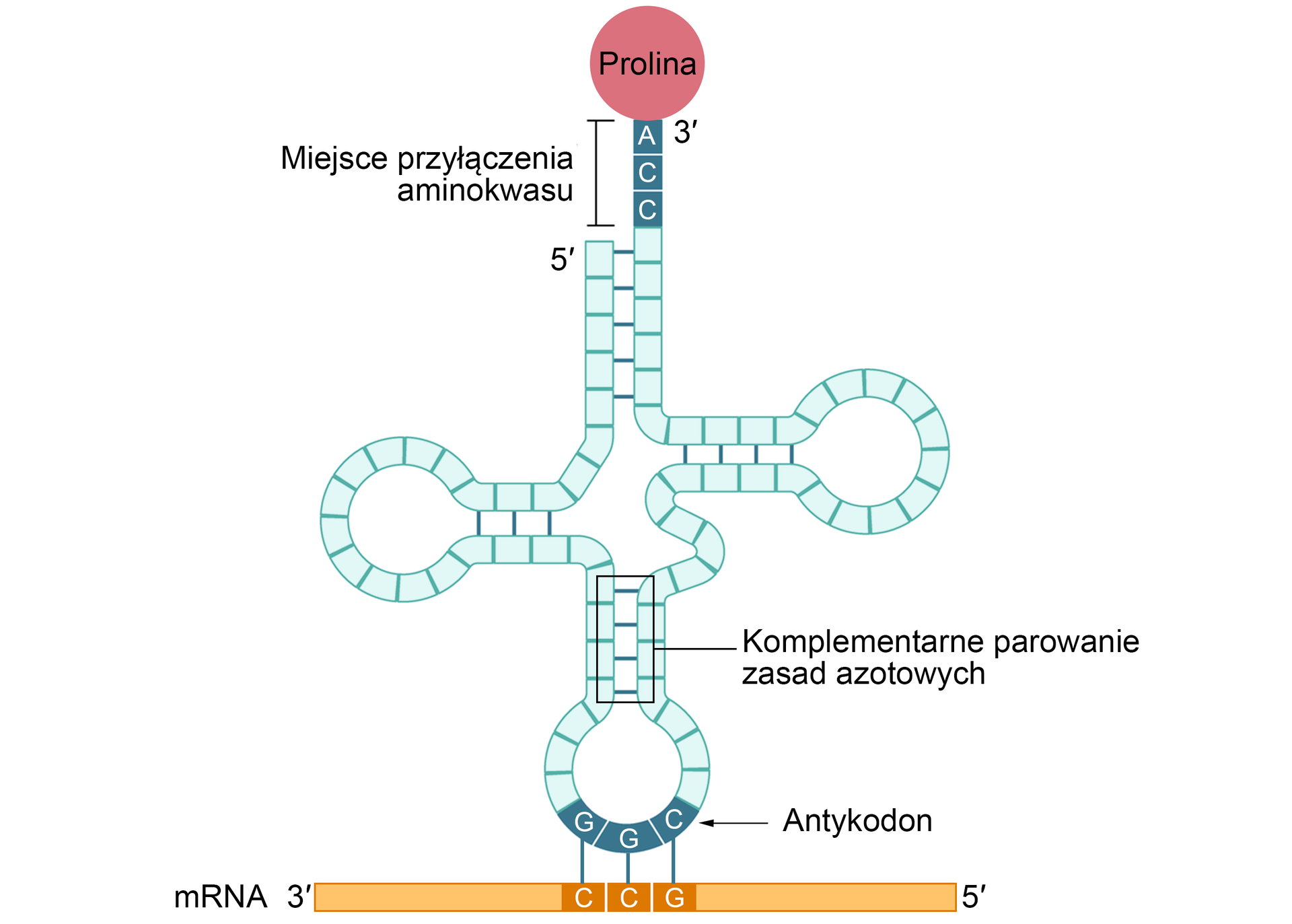
Podczas biosyntezy białka wykorzystywane są różne rodzaje tRNA, ponieważ każdy z nich może transportować tylko jeden, swoisty dla siebie aminokwas.
tRNA w komórce pełni dwie podstawowe funkcje:
rozpoznanie właściwego aminokwasu podczas interakcji tRNA oraz mRNA – na podstawie zawartej w mRNA informacji zapisanej kodem genetycznym;
przeniesienie właściwego aminokwasu do tworzonego łańcucha polipeptydowego.
Więcej na temat tRNA w e‑materiale Budowa i funkcje tRNA i rybosomówBudowa i funkcje tRNA i rybosomów.
Aminoacylacja tRNA
Aminokwas przyłączany jest do tRNA w procesie aminoacylacji. Reakcja ta jest katalizowana przez enzymy syntetazy aminoacylo‑tRNAsyntetazy aminoacylo‑tRNA, specyficzne dla danego aminokwasu.
Energia niezbędna do przeprowadzenia aminoacylacji uwalniana jest dzięki hydrolizie wysokoenergetycznych wiązań bezwodnikowych nukleotydów ATPATP i GTPGTP. Proces ten odbywa się w przestrzeni cytoplazmatycznej komórki. Poprawność przebiegu procesu aminoacylacji tRNA zapewnia prawidłową strukturę pierwszorzędową syntezowanych białek i odwzorowanie informacji kodowanej w DNA na nić polipeptydową. Wszelkie nieprawidłowości mogą z kolei prowadzić do powstawania błędnie sfałdowanych białek, mogących tworzyć agregaty i niekorzystnie wpływać na funkcjonowanie komórek.
Aminoacylo‑tRNA powstaje przez wytworzenie wiązania estrowego pomiędzy grupą karboksylową aminokwasu (–COOH) a grupą wodorotlenową (–OH) w pozycji 2′ lub 3′ nukleotydu adeninowego znajdującego się w sekwencji CCA na końcu 3′ ramienia akceptorowego tRNA.
Reakcja ta jest dwuetapowa, a na każdym z etapów niezbędna jest energia, pochodząca z rozerwania wiązania wysokoenergetycznego cząsteczki ATP lub GTP.
I etap aminoacylacji - aktywacja aminokwasu
powstanie aminoacylo‑AMP (skutkiem rozerwania dwóch wiązań wysokoenergetycznych ATP jest powstanie dwóch reszt kwasu fosforowego).
aminokwas + ATP ↔ aminoacylo‑AMP + PPIndeks dolny ii
II etap aminoacylacji - transfer aminokwasu
dochodzi do powstania aminoacylo‑tRNAaminoacylo‑tRNA, gotowego do przeniesienia aminokwasu i połączenia się z mRNA.
Uwolnione w pierwszym etapie dwie reszty kwasu fosforowego zostają wykorzystane do odtworzenia ATP, który jest niezbędny do aminoacylacji kolejnych cząsteczek tRNA.
aminoacylo‑AMP + tRNA + HIndeks dolny 22O + PPIndeks dolny ii → aminoacylo‑tRNA + ATP
Po połączeniu aminoacylo‑tRNA z resztą aparatu translacyjnegoaparatu translacyjnego, rozpoczyna się proces formowania polipeptydu – translacjatranslacja.
Syntetazy aminoacylo‑tRNA
Syntetazy aminoacylo‑tRNA to enzymy odpowiedzialne za przyłączanie odpowiednich aminokwasów do właściwych cząsteczek tRNA.
Syntetazy aminoacylo‑tRNA katalizują reakcję transestryfikacji aminokwasów do tRNA, czego efektem jest utworzenie aminoacylo‑tRNA. Opisano 23 syntetazy aminoacylo‑tRNA, z czego trzy spotyka się jedynie u bakterii i archeonów. U ludzi wstępuje 20 różnych typów syntetaz aminoacylo‑tRNA. Rolę kofaktorakofaktora pełni w nich jon magnezu (MgIndeks górny 2+2+).
Syntetazy aminoacylo‑tRNA podzielono na dwie klasy.
Klasa I:
Przeprowadzają proces aminoacylacji tRNA na grupie wodorotlenowej (–OH) w pozycji 2′ adenylanu na końcu ramienia akceptorowego tRNA.
Zazwyczaj zbudowane są z jednej lub dwóch podjednostek.
Odpowiadają za przyłączanie aminokwasów hydrofobowych.
Centrum aktywne składa się z pięciu ułożonych na przemian alfa‑helis, tworząc tzw. strukturę Rossmanna.
Odpowiadają za przyłączenie do tRNA m.in. leucyny, cysteiny, argininy i waliny.
Klasa II:
Przeprowadzają proces aminoacylacji tRNA na grupie wodorotlenowej (–OH) w pozycji 3′ adenylanu na końcu ramienia akceptorowego tRNA.
Zazwyczaj występują w formie dimerudimeru lub tetramerutetrameru.
Rozpoznają najczęściej małe aminokwasy.
Centrum aktywne tworzy siedem antyrównolegle ułożonych struktur beta‑kartki oraz trzy alfa‑helisy.
Odpowiadają za przyłączenie do tRNA m.in. seryny, proliny, histydyny, glicyny i alaniny.
W genomie mitochondrialnym człowieka występują 22 geny związane z tRNA, a wszystkie syntetazy aminoacylo‑tRNA kodowane są przez genom jądrowy. Jedynie dwie syntetazy (syntetaza lizylo‑tRNA i syntetaza glicylo‑tRNA) kodowane są przez te same geny zarówno jako białka cytoplazmatyczne, jak i mitochondrialne. W mitochondriach występuje łącznie 19 syntetaz aminoacylo‑tRNA, gdyż nie odnaleziono syntetazy dla kwasu glutaminowego. Zaburzenia związane z genami mitochondrialnych syntetaz aminoacylo‑tRNA zostały powiązane z szeregiem chorób, w tym chorobą Charcota–Mariego–Toothachorobą Charcota–Mariego–Tootha, encefalopatiąencefalopatią, mikrocefaliąmikrocefalią czy padaczką.
Syntetazy aminoacylo‑tRNA odgrywają także rolę:
w modyfikacjach potranslacyjnych białek;
w odpowiedzi immunologicznej;
w rozwoju układu nerwowego.
Wykazano, że niektóre syntetazy aminoacylo‑tRNA, takie jak syntetaza izoleucylo‑tRNA 2, syntetaza lizylo‑tRNA i syntetaza asparaginylo‑tRNA, sprzyjają rozwojowi nowotworów.
Mechanizmy naprawy błędnie sparowanych aminoacylo‑tRNA
Aby doszło do prawidłowego sparowania aminokwasu z tRNA, niezbędne jest rozpoznanie aminokwasu oraz tRNA. Syntetazy rozpoznają aminokwasy dzięki obecności miejsca wiązania aminokwasów, w które cząsteczki te dopasowują się i mogą przyłączyć się do cząsteczki ATP. Rozpoznanie tRNA ma miejsce na bazie jego struktury, a także determinant w sekwencji nukleotydowej. Determinantami mogą być pojedyncze nukleotydy, pary zasad czy motywy strukturalne tRNAmotywy strukturalne tRNA.
Reakcja aminoacylacji jest podatna na błędy, związane z niewłaściwą aktywacją aminokwasów oraz nieprawidłowym sparowaniem aminokwasu z tRNA, szczególnie w przypadku aminokwasów podobnych strukturalnie. Niebezpieczeństwo błędnego sparowania występuje w przypadku aminokwasów, które są izosteryczneizosteryczne (walina i treonina) lub różnią się tylko grupą metylową (izoleucyna i walina).
W 1985 roku Alan Fersht zaproponował model dwustopniowego zabezpieczenia przed pomyłką w sparowaniu aminokwasu z tRNA na przykładzie syntetazy izoleucylo‑tRNA. W przypadku tej syntetazy istnieje możliwość zamiany izoleucyny na walinę, ze względu na niewielką różnicę w budowie obu aminokwasów. Pierwszym z różnicujących elementów pozwalających na prawidłowe sparowanie jest wielkość aminokwasów. Aminokwasy większe od izoleucyny nie są w stanie wpasować się w miejsce wiązania aminokwasów. Drugim parametrem umożliwiającym poprawne związanie aminokwasu z tRNA przez syntetazę aminoacylo‑tRNA jest charakter hydrofilowy aminokwasu.
Proces edycji, czyli zmiany błędnie sparowanego aminokwasu, może obejmować etap po aktywacji aminokwasu lub po transferze aminokwasu na tRNA. Mechanizm edycji opiera się na aktywności hydrolitycznej syntetaz aminoacylo‑tRNA, która możliwa jest dzięki obecności domeny CP1 (ang. connective peptide 1). Domena ta odpowiada za zmianę struktury przestrzennej enzymu, która niszczy centrum aktywne przeprowadzające proces aminoacylacji.

Słownik
tRNA zawierający aminokwas przyłączony w procesie aminoacylacji
struktura przeprowadzająca translację, złożona z dwóch podjednostek rybosomalnych, mRNA i aminoacylo‑tRNA
adenozyno‑5′-trifosforan; nukleotyd, połączenie kwasu adenozynodifosforowego z resztą kwasu fosforowego wiązaniem wysokoenergetycznym
grupa chorób o charakterze dziedzicznych neuropatii
cząsteczka utworzona przez połączenie się dwóch takich samych cząsteczek prostych; najprostszy oligomer
ogólne określenie przewlekłych, rozlanych lub wieloogniskowych uszkodzeń mózgu spowodowanych różnymi czynnikami
guanozyno‑5′-trifosforan; nukleotyd o budowie i funkcjach podobnych do ATP, zawierający dwa wiązania wysokoenergetyczne
podobieństwo właściwości fizycznych cząsteczek, które zbudowane są z takiej samej liczby atomów i mają tę samą liczbę elektronów
niebiałkowy składnik niezbędny do katalitycznej aktywności wielu enzymów
małogłowie; zaburzenie rozwojowe charakteryzujące się nienaturalnie małymi wymiarami czaszki, a co za tym idzie – także mózgu
sekwencja nukleotydowa lub aminokwasowa związana z funkcją cząsteczki kwasu nukleinowego lub białka
enzym odpowiedzialny za katalizowanie reakcji aktywacji aminokwasu oraz transferu aminokwasu na tRNA
cząsteczka utworzona przez połączenie się czterech takich samych cząsteczek prostych
proces, w którym następuje przepisanie kolejności nukleotydów DNA na mRNA
drugi etap biosyntezy białka, podczas którego, na podstawie informacji zapisanej w nici mRNA, jest syntetyzowany polipeptyd