Przeczytaj
Chrom
Chrom to pierwiastek z bloku d, leżący w 6 grupie układu okresowego i 4 okresie. Posiada 5 elektronów na podpowłoce 3d. Elektrony te absorbują światło, dlatego też wodne roztwory związków chromu są barwne. Słowo chrom pochodzi od greckiego słowa „chroma”, czyli „kolor”. Jego symbol to Cr. Pierwiastek ten jest metalem aktywnym chemicznie. Pod wpływem tlenu z powietrza ulega pasywacjipasywacji, czyli pokrywa się warstewką swojego tlenku (tlenkiem chromu(III)). Dzięki temu jest odporny na korozję.
Chrom może występować na II, III lub VI stopniu utlenienia. Należy pamiętać, że chrom na VI stopniu utlenienia jest szkodliwy dla zdrowia. Tlenek chromu(VI) ma charakter kwasowy. W reakcji tlenku chromu(VI) z wodą powstaje kwas chromowy(VI) .
W chemii częściej niż kwas chromowy(VI), stosowane są jego sole: chromiany i dichromiany.
Chromiany i dichromiany
Najważniejszą solą chromu, stosowaną w przemyśle, jest chromian(VI) sodu . To ciało stałe o barwie żóltej. Wodny roztwór tej soli posiada taki sam kolor, a także dodatkowo odczyn zasadowy.
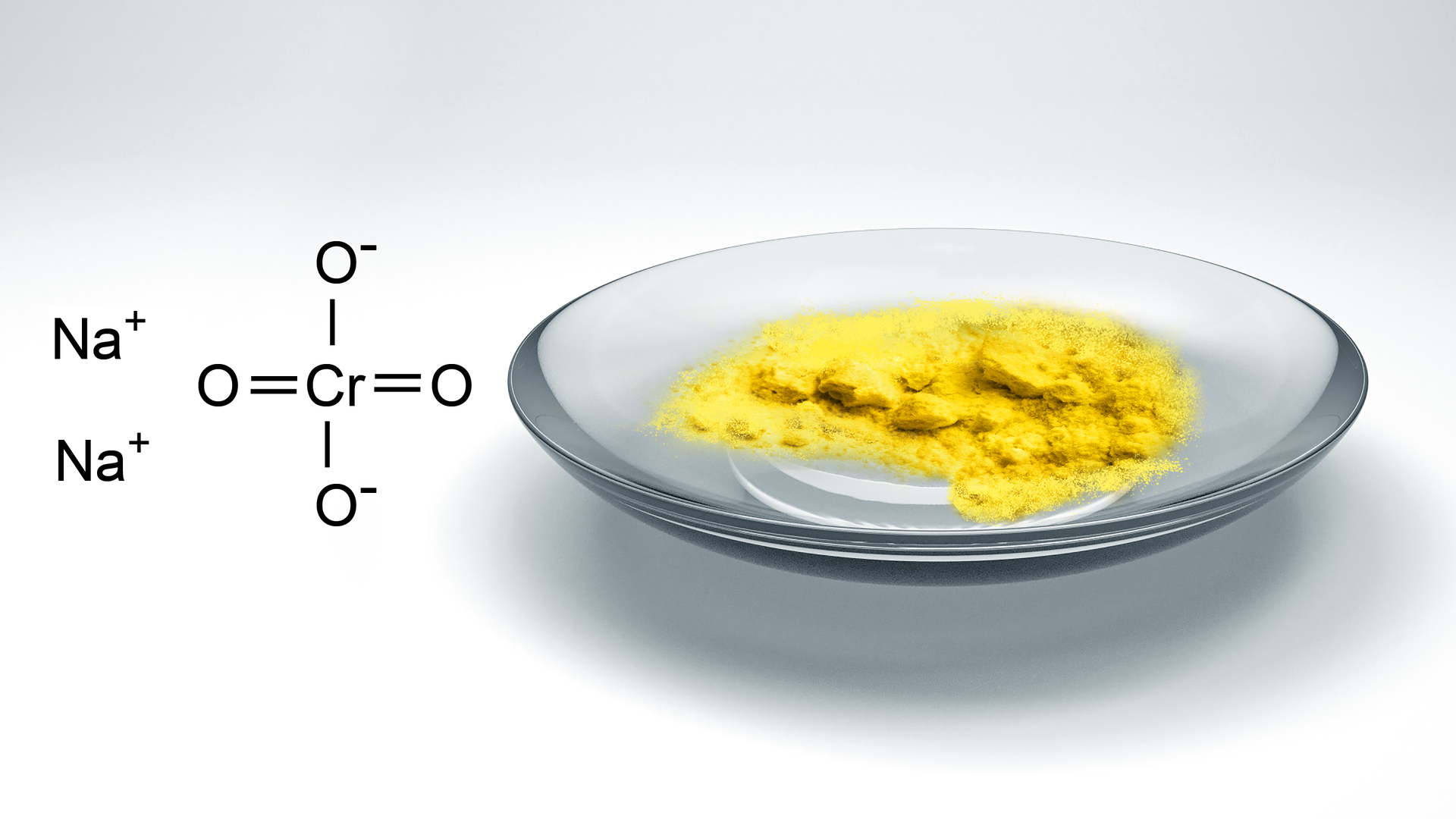
Najczęściej stosowane sole dichromianowe(VI) to dichromian(VI) sodu oraz dichromian potasu . Dichromiany to sole o barwie pomarańczowej. Powstają z soli chromianowych.

Równowaga chromian(VI) i dwuchromian(VI)
W wyniku zakwaszenia chromianu następuje zmiana barwy roztworu z żółtej na pomarańczową. Po dodaniu niewielkiej ilości jonów oksoniowych do chromianów(VI) powstają jony wodorochromianowe , które ulegają kondensacjikondensacji do jonów heptaoksodichromianowych . Z żółtego chromianu(VI) powstaje pomarańczowy dichromian(VI).
Równanie reakcji powstawania jonu wodorochromianowego:
Mechanizm kondensacji jonów wodorochromianowych do jonów heptaoksodichromianowych :

Zapis cząsteczkowy równania reakcji chemicznej:
Zapis jonowy skrócony:
Reakcja ta jest reakcją odwracalną. Po dodaniu wodorotlenku do pomarańczowego roztworu dichromianu(VI) powstaje żółty chromian(VI).
Zapis cząsteczkowy równania reakcji chemicznej:
Zapis jonowy skrócony:
Warto wspomnieć, że gdy do chromianów dodamy dużej ilości stężonego kwasu siarkowego(VI), to w wyniku kondensacji może dojść do wydzielenia z roztworu czerwonego tlenku chromu(VI) .
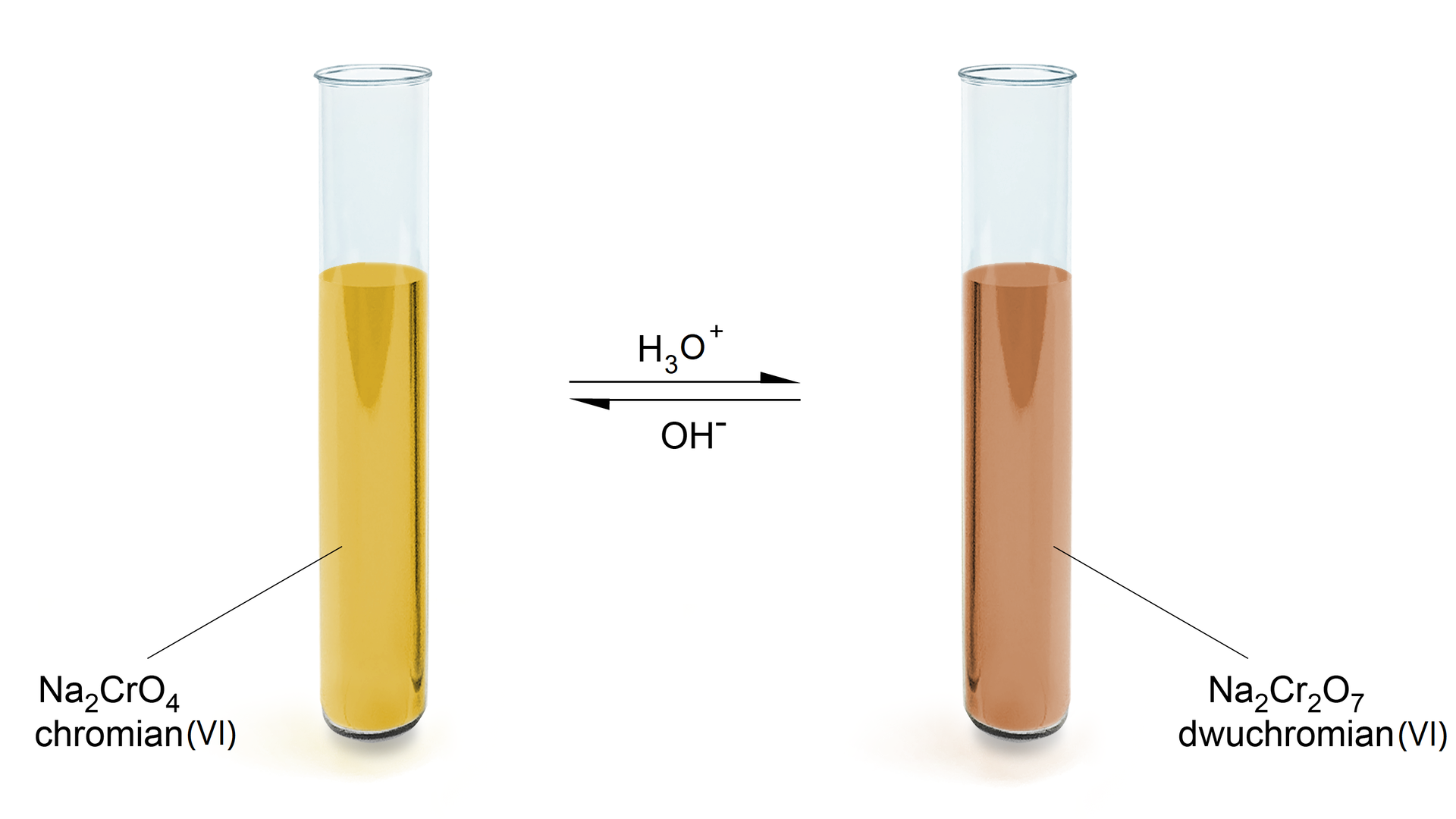
Podsumowując, w środowisku kwasowym jony chromianowe(VI) tworzą jony dichromianowe(VI) . W środowisku zasadowym jony dichromianowe(VI) tworzą jony chromianowe(VI) . Wynika z tego, że równowaga chromian(VI) - dichromian(VI) w roztworze zależy od pH. W pH kwasowym występują chromiany(VI), a w pH zasadowym dichromiany(VI).
Słownik
to reakcja chemiczna, polegająca na łączeniu się substratów w większy od nich produkt
pokrywanie powierzchni metalu cienką warstwą związku (tlenkiem), zapobiegając tym samym dalszemu utlenianiu
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010.
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura. Chemia. Vademecum, Warszawa 2018.
Litwin M., Styska‑Wlazło S., Szymońska J., To jest chemia 1. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2012.