Przeczytaj
Estry powstają w wyniku kondensacji kwasów (organicznych lub nieorganicznych) i alkoholi lub fenoli. Jedną z najpopularniejszych metod jest reakcja kwasu karboksylowego i alkoholu w środowisku kwasu, najczęściej jest to kwas siarkowy().
Jak przebiega proces estryfikacji?
Pamiętaj, że proces estryfikacji zachodzi zgodnie z mechanizmem substytucji nukleofilowej.
W wyniku reakcji estryfikacji następuje zastąpienie grupy hydroksylowej , pochodzącej z kwasu karboksylowego, i podłączenie grupy alkoholu. Reakcje można przedstawić następująco;
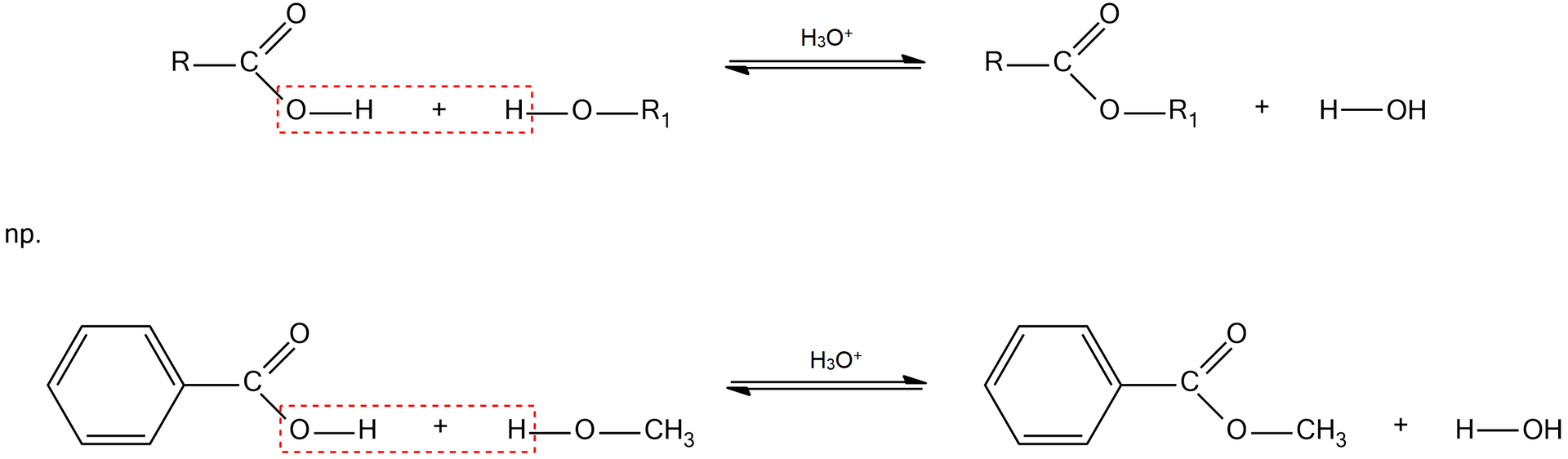
Jak możesz zauważyć w równaniu reakcji, pomiędzy substratami a produktami narysowana jest strzałka w dwie strony. Oznacza to, że reakcja jest odwracalna i przebiega z zachowaniem równowagi chemicznejrównowagi chemicznej. Kwas nieorganiczny w tej reakcji pełni rolę katalizatorakatalizatora i jest niezbędny do jej przeprowadzania, jako katalizatora używa się kwasu siarkowego() ze względu na jego właściwości higroskopijnehigroskopijne. Po pewnym czasie ustala się stan równowagi – mówiąc prościej, stosunek ilości substratów do produktów jest stały i się nie zmienia – oznacza to, że nie możemy otrzymać produktu np: ze wydajnością. By zwiększyć wydajność reakcji, należy na bieżąco usuwać ester z układu reakcyjnego np.: poprzez destylację. Zwiększenie wydajności reakcji zachodzi zgodnie z regułą przekoryregułą przekory. Jak widzisz, w reakcji powstaje również cząsteczka wody. Gdybyśmy do mieszaniny reakcyjnej dodali wody, równowaga chemiczna reakcji przesunęłaby się w stronę substratów. Dlatego używane w nich estry charakteryzują się małą trwałością. Podczas pocenia się nasz organizm wydziela wodę, która powoduje rozkład estru do kwasu karboksylowego i alkoholu.
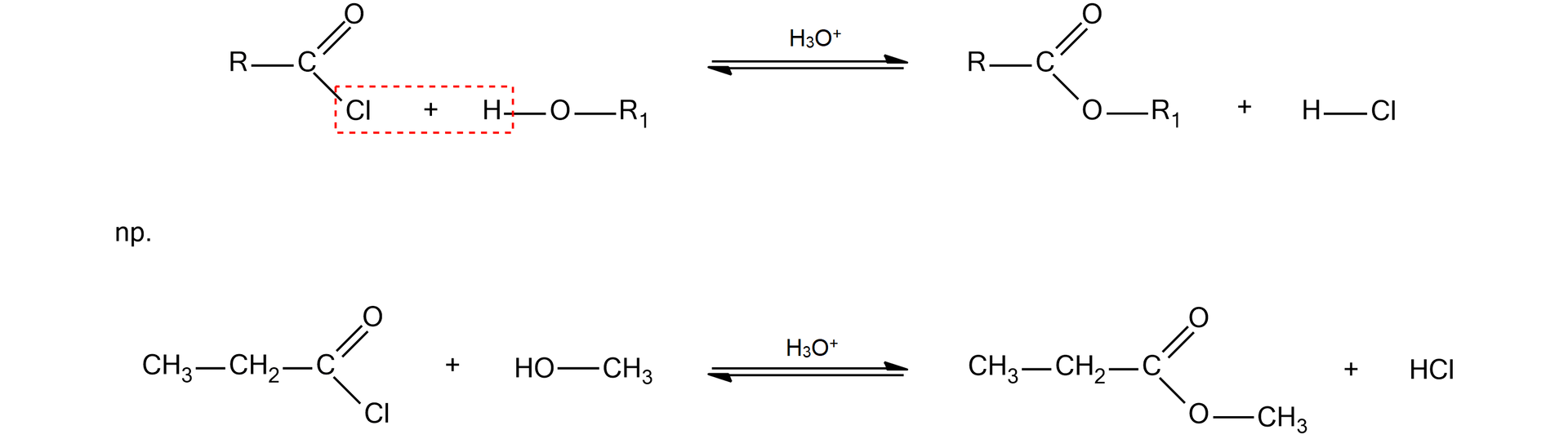
Estry powstają również w wyniku reakcji chlorków kwasowych z alkoholami.
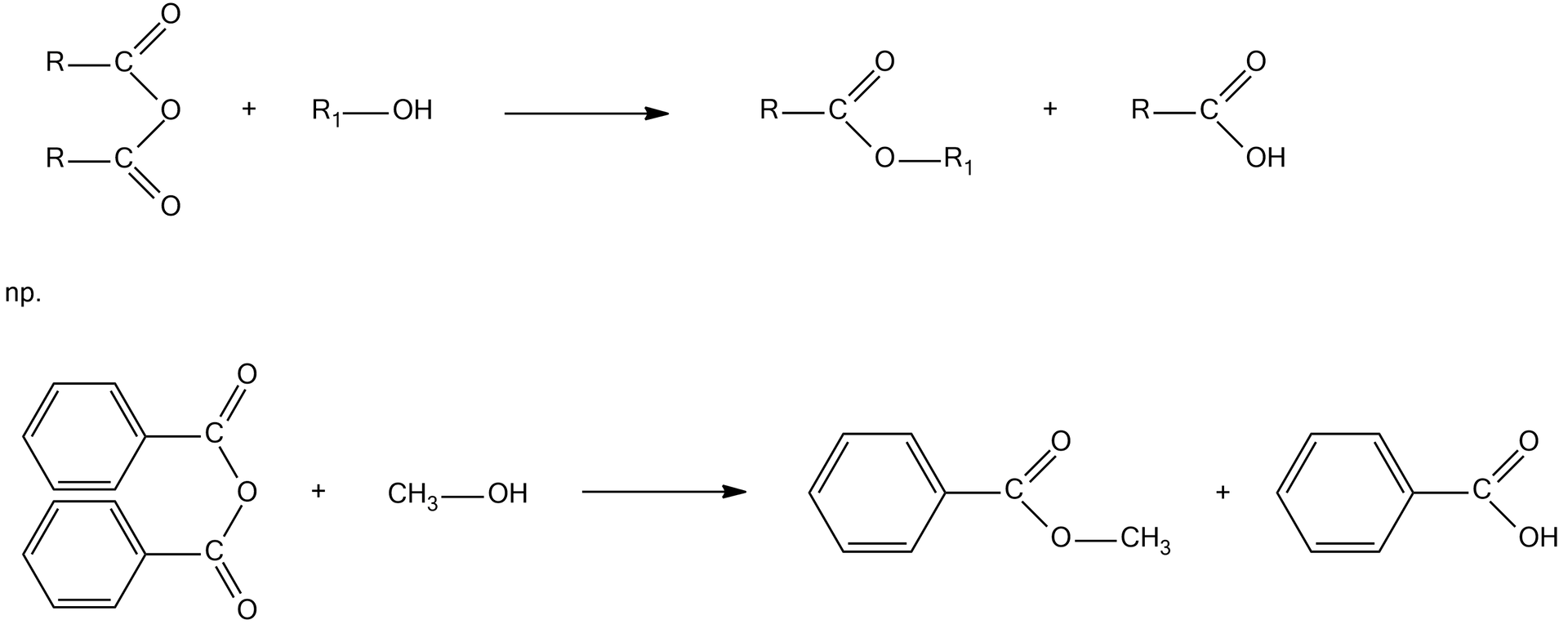
Alkoholiza to reakcja, której ulegają np. estry, bezwodniki i chlorki kwasowe:
Alkoholiza chlorku kwasowego:
Alkoholiza bezwodnika kwasowego:
Proces estryfikacji na przykładzie monosacharydów
Monosacharydy mogą uczestniczyć w reakcji estryfikacji. Szczególne znaczenie biologiczne mają fosforany() monosacharydów. Miejscem estryfikacji w cząsteczce monosacharydu może być:
grupa przy - lub - dla aldoz;
grupa przy - lub - dla ketoz.
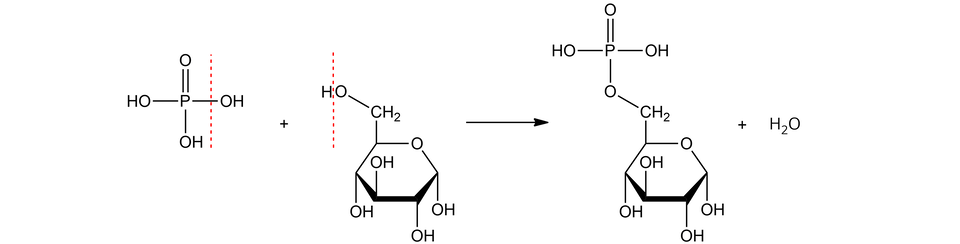
Nazwy fosforanów() monosacharydów (estrów) tworzy się poprzez dodanie do nazwy monosacharydu numeru atomu węgla, którego grupa została zestryfikowana, oraz słowa „fosforan()”, np. --glukopiranozo--fosforan(). Gdy estryfikacji ulega grupa przy anomerycznym atomie węgla, to nazwa cukru przybiera końcówkę „-zylo” zamiast „-zo”, a następnie dodaje się słowo „fosforan()”, np. --glukopiranozylo--fosforan().
Słownik
w ujęciu kinetycznym — stan, do którego dąży układ w miarę przebiegu reakcji odwracalnej
substancje zdolne do pochłaniania pary wodnej i wody
Le Chateliera i Brauna reguła, reguła przeciwdziałania: reguła głosząca, że układ będący w stanie równowagi chemicznej, poddany działaniu czynnika z zewnątrz, reaguje w taki sposób, żeby zmniejszyć wpływ tego czynnika i osiągnąć nowy stan równowagi możliwie niezbyt odległy od stanu równowagi wyjściowej
katalizator [gr.] substancja, która zwiększa szybkość reakcji chemicznej, nie naruszając stanu końcowej równowagi i właściwości termodynamicznych układu i pozostając w stanie niezmienionym po zakończeniu reakcji
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia : Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.