Przeczytaj
Różnice w budowie aldehydów i ketonów
Aldehydy i ketony posiadają charakterystyczne grupy funkcyjne – ketonową i aldehydową. Różnica między aldehydem a ketonem polega na obecności atomu wodoru przyłączonego do grupy karbonylowej w aldehydzie. W ketonach atom wodoru nie występuje. W ketonach zamiast niego występuje reszta oznaczona R', pod czym może kryć się np. grupa alkilowa.
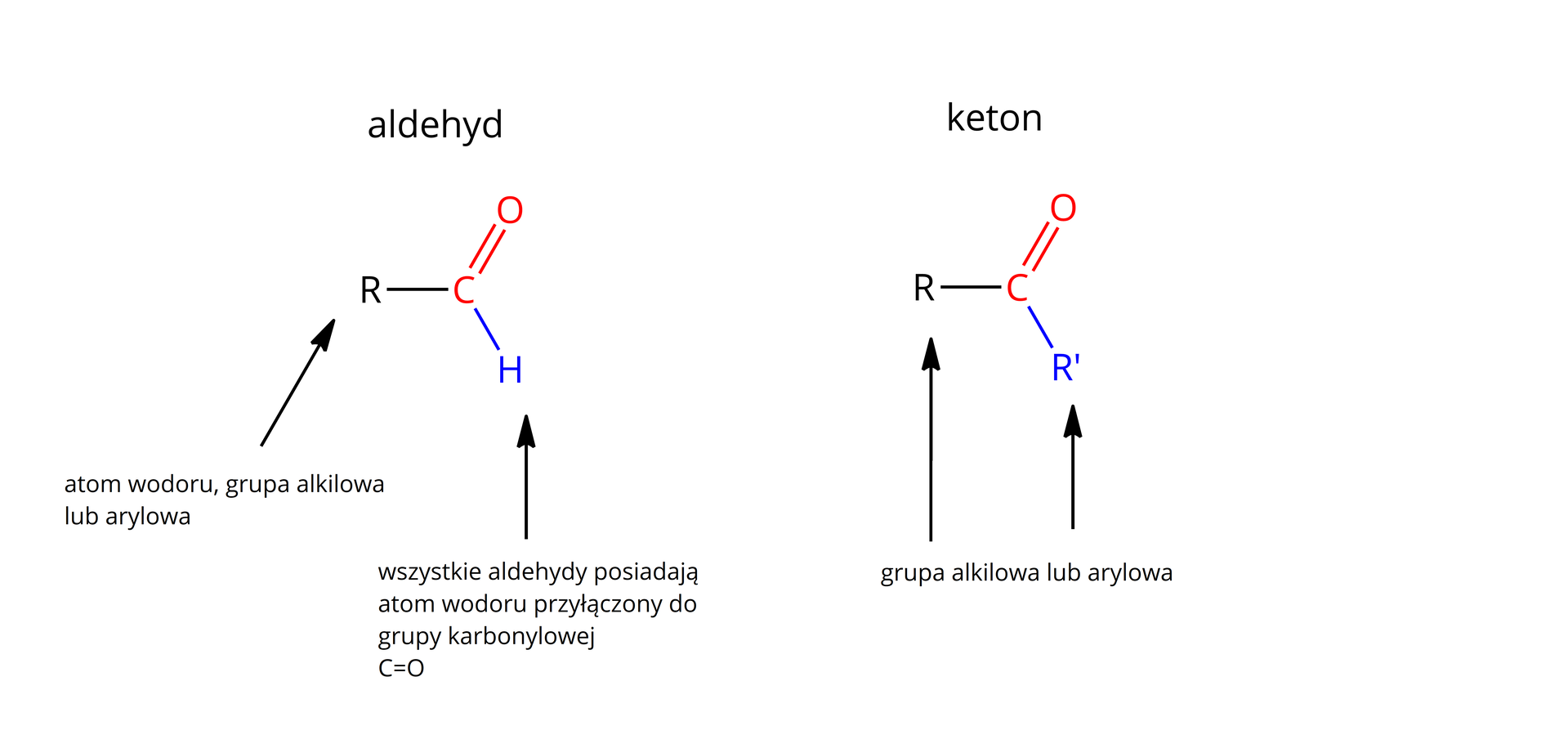
To właśnie różnice w budowie aldehydów i ketonów warunkują różnice w ich właściwościach chemicznych. W laboratorium, aby szybko sprawdzić, czy mamy do czynienia z aldehydem czy ketonem, wykorzystuje się proste reakcje charakterystyczne, omówione w dalszej części lekcji.
Odróżnianie aldehydów i ketonów
Próba Trommera
Próbę Trommera warto wykonać za każdym razem, kiedy trzeba sprawdzić, czy badany związek wykazuje właściwości redukujące. Aldehydy są związkami redukującymi, ponieważ posiadają grupę aldehydową. Dają więc pozytywny wynik próby Trommera. Ketony z kolei nie wykazują właściwości redukujących, ponieważ nie posiadają atomu wodoru przy grupie karbonylowej. Odczynnik Trommera przygotowuje się, dodając wodny roztwór wodorotlenku sodu do wodnego roztworu siarczanu miedzi . Otrzymany niebieski koloidalny osad wodorotlenku miedzi ogrzewa się następnie z badanym związkiem w środowisku zasadowym. W przypadku pozytywnego wyniku testu, miedź z stopnia utlenienia redukuje się do .
Próba Fehlinga
Próba Fehlinga jest modyfikacją próby Trommera, a jedyną różnicą jest wykorzystanie kompleksu kationów miedzi z winianem zamiast wodorotlenku miedzi. Kompleks kationów miedzi z winianem jest lepiej rozpuszczalny i bardziej reaktywny.
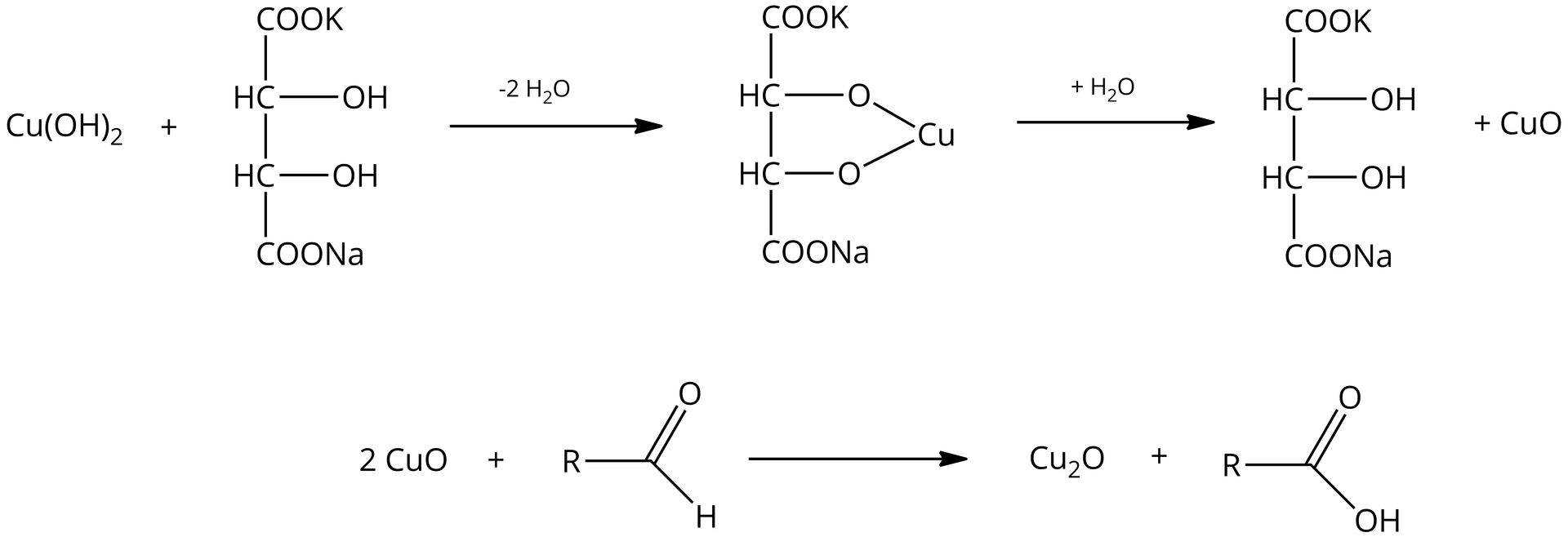
W przypadku obecności związku o właściwościach redukujących (reduktorareduktora) próba Fehlinga daje wynik pozytywny. Wówczas zaobserwować można wytrącenie się ceglastoczerwonego osadu, co jest związane ze zmianą stopnia utlenienia miedzi z na .

Próba Tollensa
Próba Tollensa nazywana jest inaczej próbą lustra srebrowego ze względu na produkt reakcji podczas pozytywnego wyniku próby – metaliczne srebro osadzające się na ściankach probówki. Również wykonuje się ją w celu oznaczenia jakościowego związku o właściwościach redukujących. Jest to reakcja opierająca się na utlenianiuutlenianiu i redukcjiredukcji. Prowadzona jest w lekko zasadowym środowisku. Do wykonania próby Tollensa wykorzystuje się odczynnik Tollensa, czyli roztwór zawierający jony diaminasrebra , powstały przez dodanie wody amoniakalnej do roztworu azotanu srebra. W reakcji ze związkiem redukującym jon diaminasrebra redukuje się do metalicznego srebra.
Ketony dają negatywny wynik prób, z wyjątkiem cukrów z grupy ketoz, ponieważ ketozy w zasadowym środowisku ulegają epimeryzacjiepimeryzacji do aldoz. Dzięki temu cukry zyskują ugrupowanie aldehydowe, a co za tym idzie również właściwości redukujące.
Podsumowanie
Ketony nie utleniają się tak łatwo jak aldehydy i dlatego w próbie Tollensa i Trommera otrzymujemy negatywny wynik reakcji, świadczący o braku właściwości redukujących. Dzieje się tak przez brak atomu wodoru w grupie karbonylowej ketonów. Na tej podstawie możemy odróżnić aldehydy i ketony.
Słownik
(łac. oxidatio „utlenianie”) oksydacja; chem. proces, polegający na oddaniu elektronu (elektronów) przez jon, atom lub grupę atomów, w wyniku czego podwyższa się stopień utlenienia pierwiastka, który oddaje elektrony
(łac. reduco „zmniejszenie, ograniczenie, zniżenie”) elektronizacja; chem. proces, polegający na pobraniu elektronu (elektronów) przez jon, atom w wyniku czego maleje stopień utlenienia pierwiastka
(łac. reduco „zmniejszać”) chem. substancja, oddająca elektrony substancji redukowanej, sama zaś ulega utlenieniu
(łac. oxidatio „utlenianie”) chem. atom, jon lub cząsteczka, która w reakcji oksydacyjno‑redukcyjnej jest akceptorem elektronu (elektronów)
rodzaj izomeryzacji zachodzącej w cząsteczkach związków organicznych, zwłaszcza sacharydów, polegający na zmianie konfiguracji jednego z kilku centrów chiralności np. d‑glukoza ulega epimeryzacji do d‑mannozy
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Wydawnictwo Szkolne PWN, Warszawa – Bielsko‑Biała 2010.