Przeczytaj
Właściwości chemiczne amin
Właściwości chemiczne aminamin można porównać do właściwości chemicznych amoniaku, ze względu na podobieństwo w budowie cząsteczek tych związków.
Amoniak i aminy wykazują charakter zasadowy (reagują z kwasami, ale nie reagują z zasadami), a wodne roztwory tych związków chemicznych odznaczają się zasadowym odczynem.
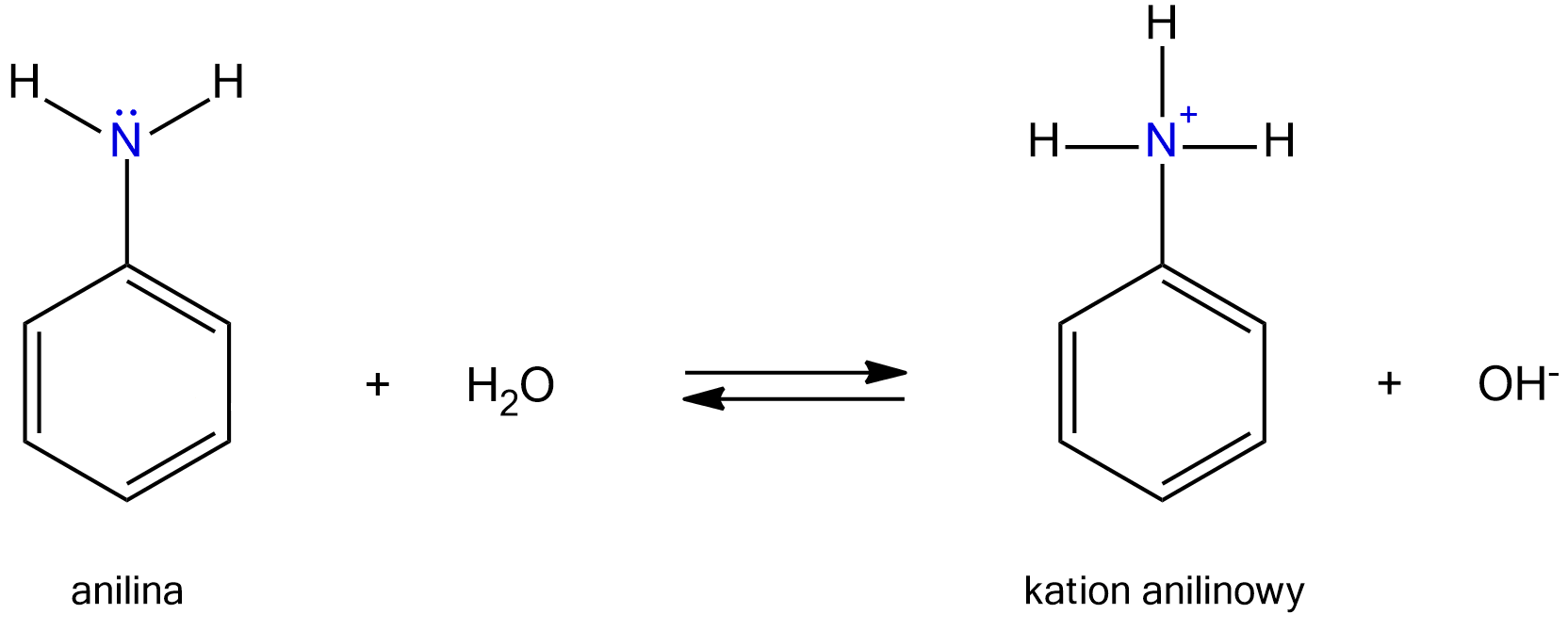
Odczyn zasadowy wodnych roztworów amin i amoniaku, jak i charakter zasadowy tych związków, wynikają z obecności wolnej pary elektronowej na atomie azotu, w cząsteczkach tych związków. Amoniak i odpowiednie aminy ulegają reakcjom z wodą. W reakcjach tych cząsteczki wody przekazują protony (kationy wodoru), cząsteczkom amoniaku lub amin. Zgodnie z teorią kwasów i zasad Brønsteda i Lowry'ego, woda w opisanej reakcji pełni rolę kwasu (protonodawcy), a amoniak lub amina – rolę zasady (protonobiorcy). Produktami reakcji są zaś kationy amonu (w przypadku amoniaku) lub kationy amoniowe (w przypadku amin) oraz aniony wodorotlenkowe. To właśnie obecność w roztworze anionów wodorotlenkowych odpowiada za jego zasadowy odczyn.

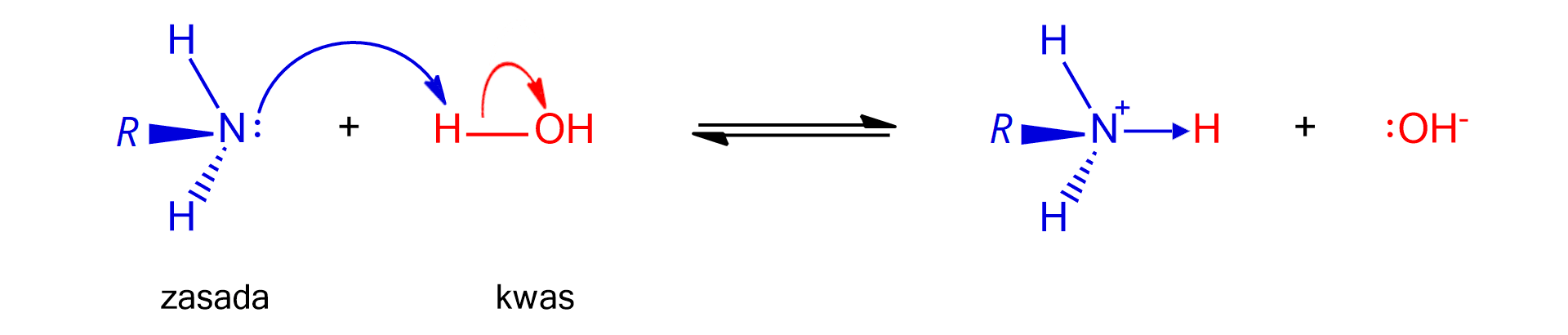
Pomiędzy niezdysocjowanymi cząsteczkami aminy, a jonami pochodzącymi z jej dysocjacji, ustala się równowaga dynamiczna. Tworzące się w powstałym kationie nowe wiązanie to wiązanie koordynacyjne, czyli donorowo‑akceptorowe – donorem pary elektronowej jest atom azotu, a jej akceptorem – kation wodoru.
Moc amin określa stała dysocjacji zasadowej (zasadowości) . Dla dowolnej -rzędowej aminy stała wyraża się wzorem:
Im wyższa wartość stałej , tym bardziej równowaga reakcji przesunięta jest w ‘prawo’, czyli tym większe jest stężenie jonów wodorotlenkowych, co z kolei powoduje wzrost mocy zasad.
W literaturze chemicznej operuje się też wielkością , zdefiniowaną następująco:
.
Im mocniejsza zasadamocniejsza zasada, tym wartość jej stałej jest mniejsza.
Aminy są słabymi zasadami organicznymi. Ich wartości mieszczą się na ogół w granicach: -.
Zasada | Stała dysocjacji |
|---|---|
| |
| |
| |
| |
| |
| |
|
Indeks górny Źródło: Ł. Banasiak, J. Filipska, A. Grabowska, T. Ishikawa, M. Mroczek Wybrane wzory i stałe fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki, Warszawa 2022. Indeks górny koniecŹródło: Ł. Banasiak, J. Filipska, A. Grabowska, T. Ishikawa, M. Mroczek Wybrane wzory i stałe fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki, Warszawa 2022.
Aminy alifatyczneAminy alifatyczne są nieco mocniejszymi zasadami od amoniaku.
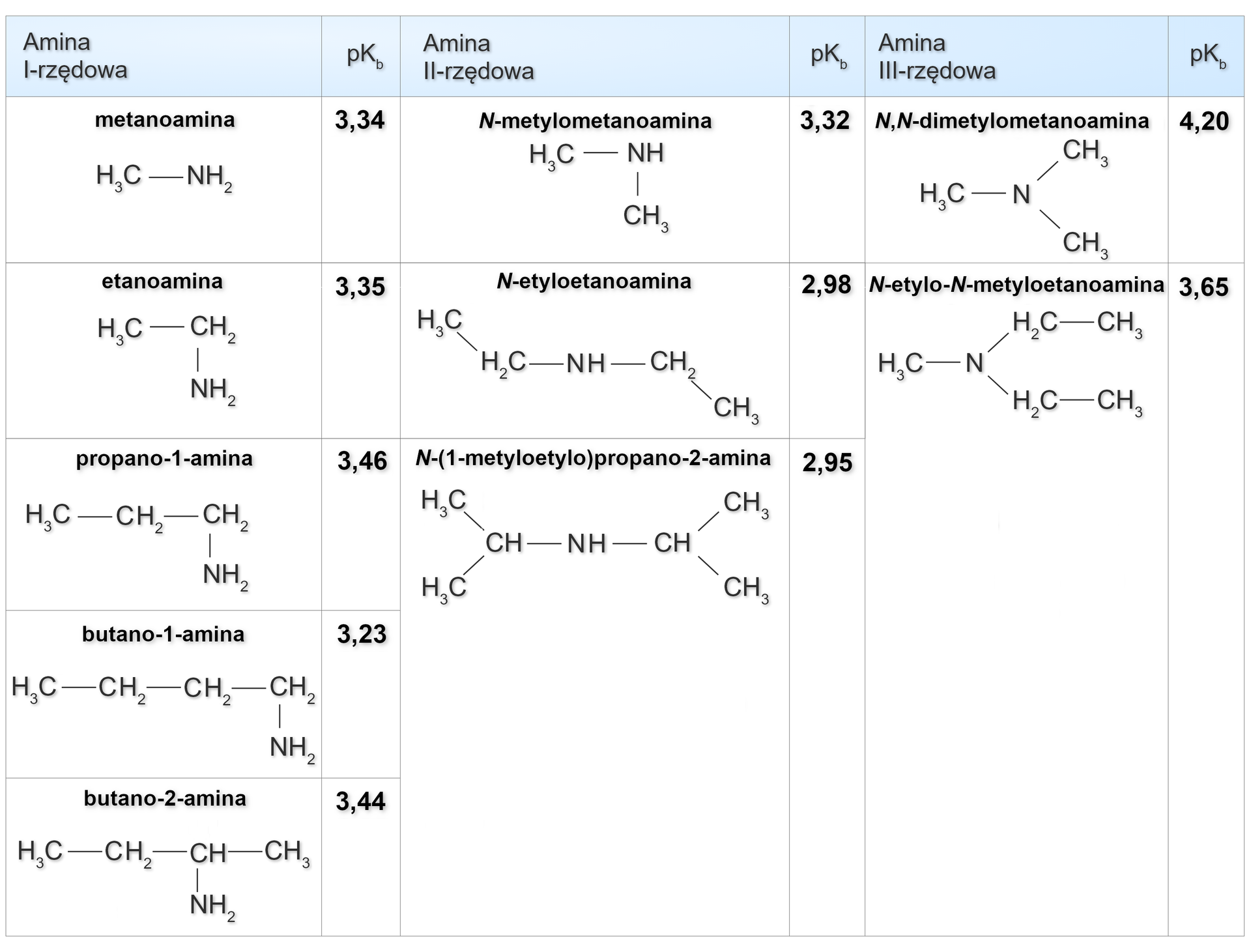
Efekt ten można wyjaśnić wpływem indukcyjnymindukcyjnym grup alkilowych, który powoduje zwiększenie gęstości elektronowej () na atomie azotu (lub też odpychaniem pary elektronowej azotu przez chmurę elektronową grup alkilowych i zwiększenie tym samym powinowactwa wolnej pary do protonu).
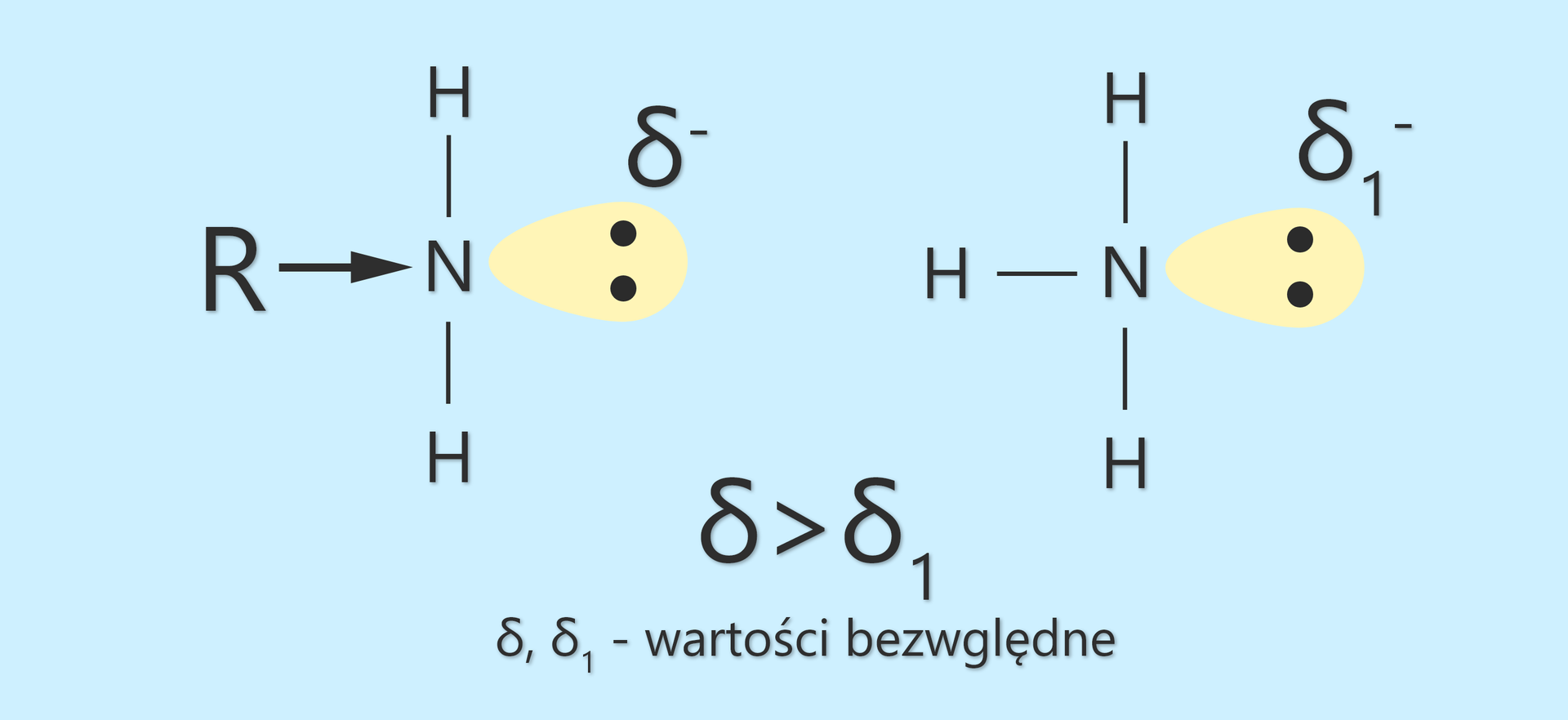
Należy podkreślić, że grupy alkilowe przyciągają elektrony słabiej od atomu wodoru. Mówi się wtedy o ich dodatnim efekcie indukcyjnym. Grupy, które słabo przyciągają elektrony, przyczyniają się do nasilenia właściwości zasadowych zasad i osłabienia właściwości kwasowych kwasów. Jeśli porównamy wartości amoniaku i metanoaminy, to okaże się, że amoniaku ma wyższą wartość niż metanoaminy (lub stała zasadowa amoniaku ma niższą wartość niż stała zasadowa metanoaminy). Metanoamina jest zatem mocniejszą zasadą niż amoniak.
Zgodnie z powyższym można wnioskować, że zasadowość amin powinna rosnąć wraz ze wzrostem ich rzędowości. W rzeczywistości zmiany takie obserwuje się jedynie w fazie gazowej.
W roztworach wodnych, położenie stanu równowagi między jonami a niezdysocjowanymi cząsteczkami amin, zależy nie tylko od gęstości elektronów na atomie azotu w cząsteczce aminy, lecz także od możliwości solwatowania tworzącego się kationu (solwatacja obniża bowiem energię kationu). W cząsteczce aminy trzeciorzędowej, wokół wolnej pary elektronowej zlokalizowanej na atomie azotu, znajdują się trzy podstawniki. Podstawniki te stanowią zawadę steryczną (przestrzenną), utrudniając dostęp wolnej pary elektronowej do protonu. Przez wzgląd na wspomnianą zawadę steryczną, dla amin trzeciorzędowych, możliwość solwatacji kationu jest znacznie mniejsza niż dla amin niższej rzędowości.
Zależność zasadowości amin od ich rzędowości, obserwowaną w roztworach wodnych, można zapisać jako:
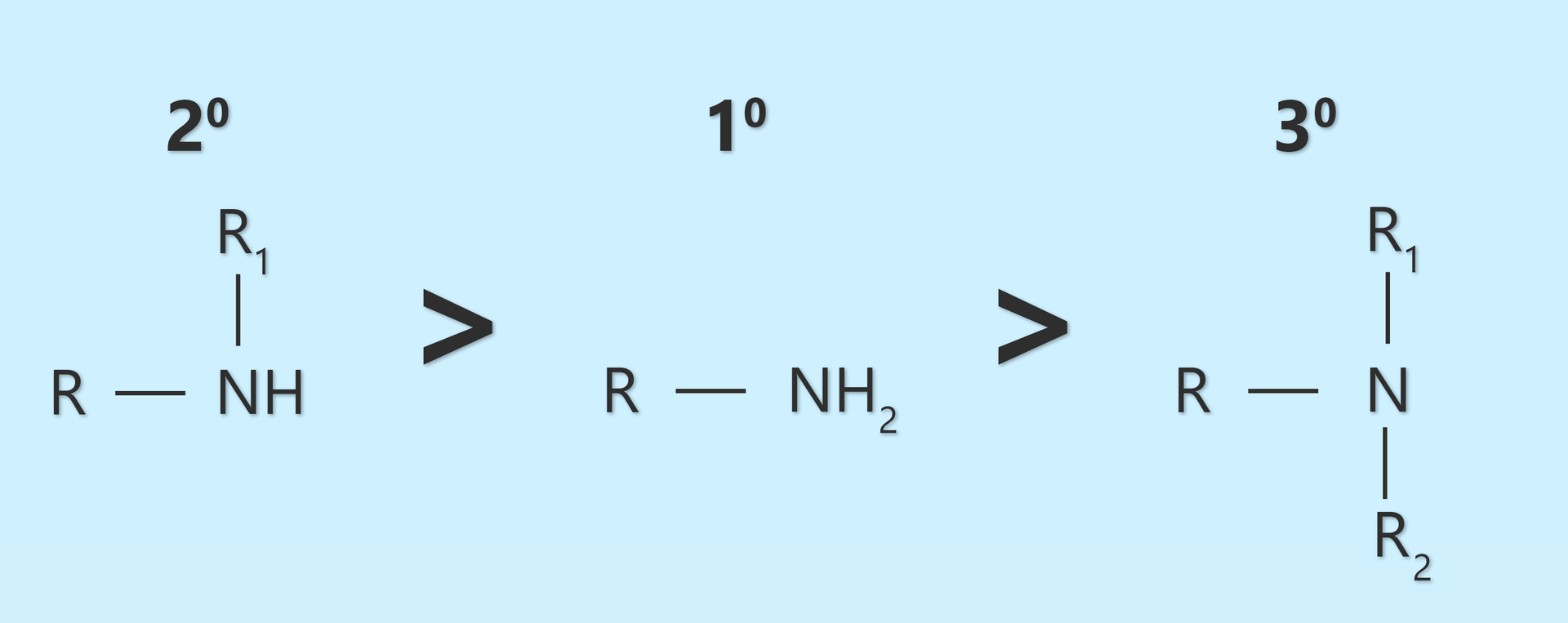
Wynika z tego, że aminy -rzędowe są słabszymi zasadami od amin - i -rzędowych.
Porównując zasadowość amin alifatycznych z aromatycznymiaromatycznymi, należy zauważyć, że są one silniejszymi zasadami od amin aromatycznych. Wynika to z oddziaływania wolnej pary elektronowej atomu azotu z sekstetem elektronowym pierścienia aromatycznego (układ aromatyczny odgrywa zasadniczą rolę elektronoakceptorową, zmniejszając gęstość elektronową na atomie azotu grupy aminowej). W wyniku tego maleje cząstkowy ładunek ujemny atomu azotu i pojawia się cząstkowy ładunek dodatni.
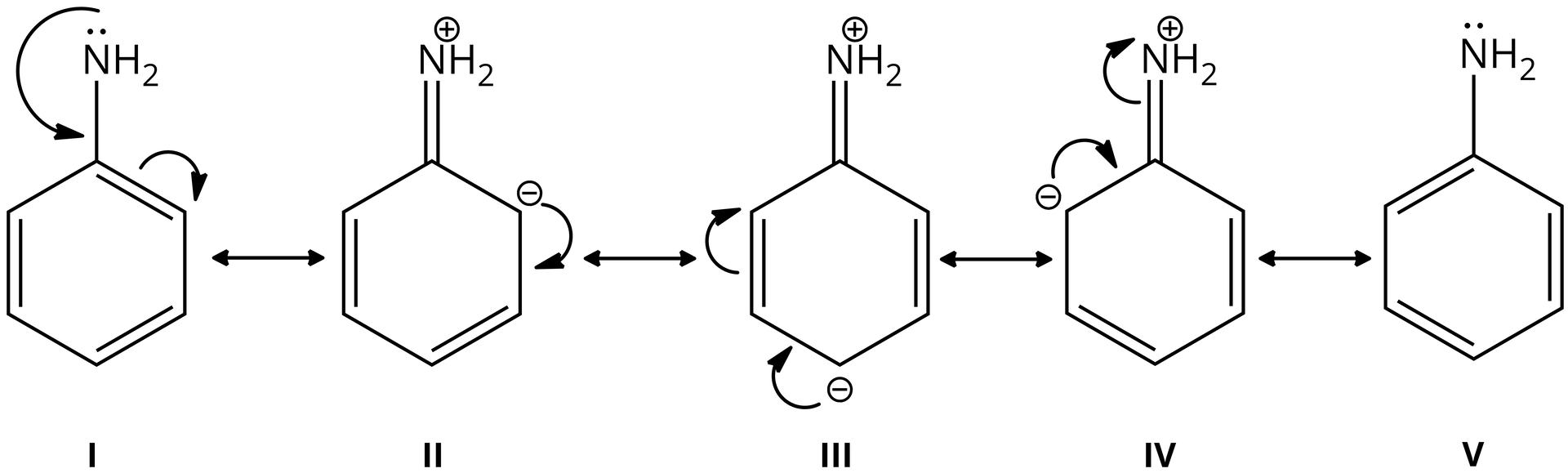
Cząstkowy ładunek ujemny pojawia się również na atomach węgla orto- i para- pierścienia aromatycznego (rysunki powyżej). Taki rozkład cząstkowych ładunków powoduje obniżenie zdolności atomu azotu do przyłączenia protonu.
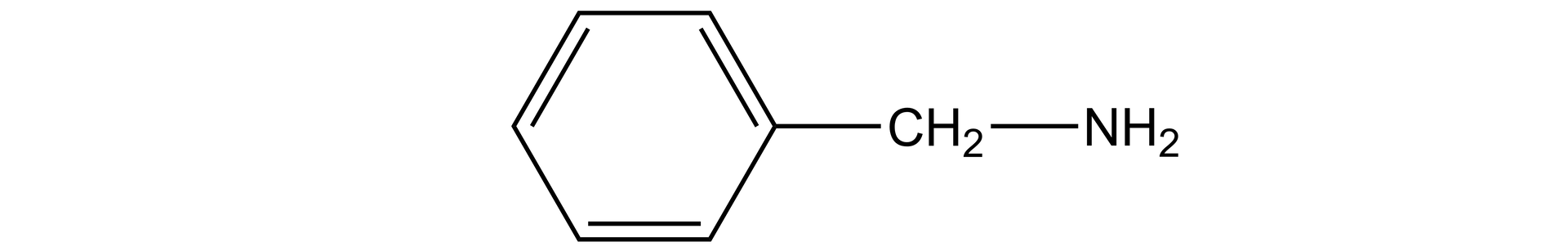
-fenylometanoamina jest aminą typu alifatycznego i wartość jej () jest zbliżona do wartości amin zawierających grupy alkilowegrupy alkilowe.
Zasadowość amin aromatycznych maleje wraz ze wzrostem liczby grup arylowychgrup arylowych związanych z atomem azotu. N,N-difenyloanilina jest tak słabą zasadą,słabą zasadą, że nie rozpuszcza się w wodnych roztworach kwasów.
Zasadowość podstawionych amin aromatycznych
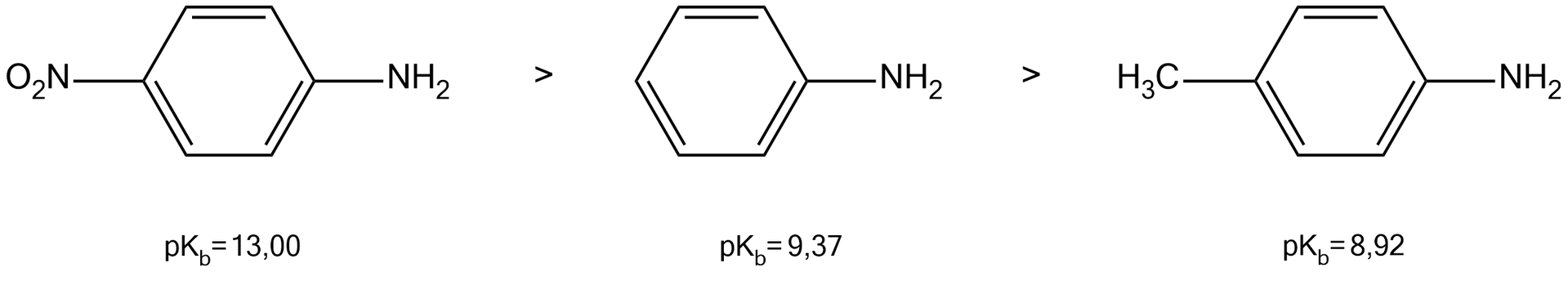
Podstawniki pierwszego rodzaju (elektronodonorowe – „dostarczające” elektrony do pierścienia) zwykle zwiększają zasadowość amin aromatycznych. Obecność tych podstawników w pierścieniu, skutkuje bowiem zwiększeniem gęstości elektronowej na atomie azotu w grupie aminowej, bezpośrednio związanej z pierścieniem.
Z kolei podstawniki drugiego rodzaju (elektronoakceptorowe – „wyciągające” elektrony z pierścienia) zwykle zmniejszają zasadowość amin aromatycznych. Ich obecność wpływa na zmniejszenie gęstości elektronowej na atomie azotu w grupie aminowej, bezpośrednio związanej z pierścieniem.
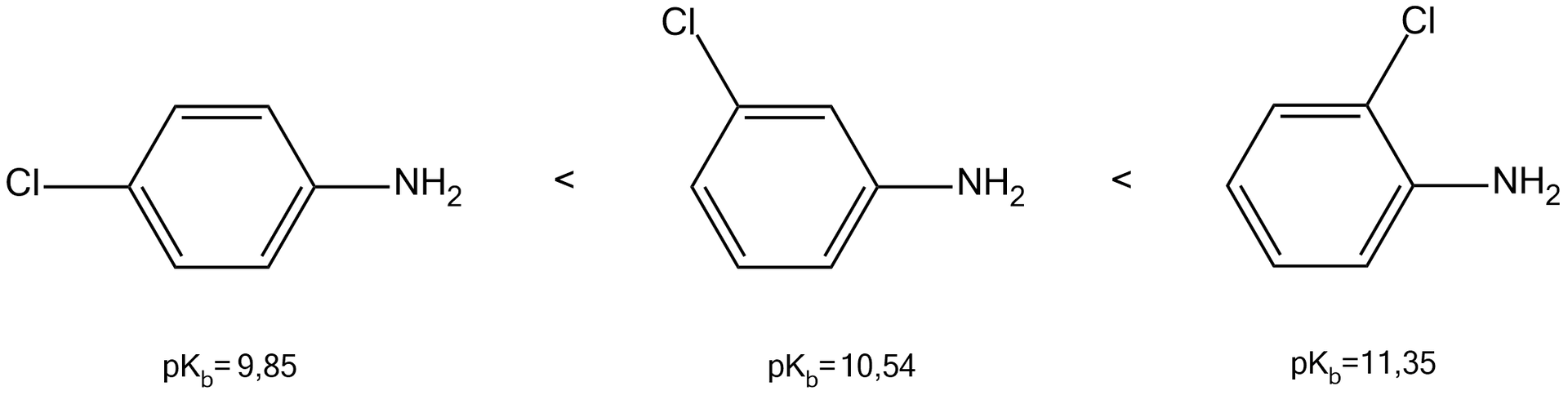
Natomiast fluorowce, chociaż należą do podstawników rodzaju (kierują inne podstawniki w położenie orto i para), wykazują działanie dezaktywujące pierścień. Obecność atomu fluorowca w pierścieniu zmniejsza zasadowość amin aromatycznych. Wynika to z faktu, że efekt indukcyjny (elektronoakceptorowy – spowodowany dużą elektroujemnością atomów fluorowców) przeważa tu nad wpływem elektronodonorowym związanym ze sprzężeniem wolnej pary elektronowej z sekstetem aromatycznym.
Reaktywność amin
Aminy wykazują charakter zasadowy, zatem mogą reagować z kwasami, tworząc sole. Przykładowo, w reakcji metanoaminy z kwasem chlorowodorowym tworzy się sól – chlorek metanoamoniowy (chlorek metanoaminium).
A w reakcji aniliny z kwasem chlorowodorowym tworzy się sól – chlorowodorek aniliny (chlorek anilinium).
Należy również pamiętać, że wszystkie aminy są słabymi zasadami, więc mogą być wyparte ze swoich soli za pomocą mocnych zasad, np. wodnego roztworu wodorotlenku sodu, zgodnie z poniższymi równaniami reakcji:
Słownik
organiczne związki chemiczne zawierające w swojej budowie grupę aminową (, lub ) przyłączoną do atomu węgla, będącą organiczną pochodną amoniaku, gdzie to odpowiednie grupy węglowodorowe; aminy to organiczne pochodne amoniaku
to związki organiczne, w cząsteczkach których grupa aminowa (, lub ) przyłączona jest bezpośrednio do atomu węgla łańcucha alifatycznego (węglowodorowego)
to związki organiczne, w cząsteczkach których grupa aminowa (, lub ) przyłączona jest bezpośrednio do atomu węgla pierścienia aromatycznego
jednowartościowa grupa utworzona przez oderwanie jednego atomu wodoru od cząsteczki alkanu
grupa utworzona przez oderwanie jednego atomu wodoru od pierścienia aromatycznego
pochodna alkanu, w której cząsteczce jeden lub więcej atomów wodoru został zastąpiony przez atom halogenu (np. chlor, brom, jod czy fluor)
stosunek iloczynu stężeń jonów powstających podczas dysocjacji elektrolitycznej do stężenia form niezdysocjowanych, pozostających w równowadze chemicznej z jonami; jest to wielkość stała w danej temperaturze
elektrolity, które ulegają niemal całkowicie reakcji z wodą; zgodnie z teorią Bronsteda-Lowry'ego pełnią w reakcjach z wodą funkcję protonobiorców (są akceptorami protonów)
elektrolity, które jedynie częściowo ulegają reakcji z wodą; zgodnie z teorią Bronsteda-Lowry'ego pełnią w reakcjach z wodą funkcję protonobiorców (są akceptorami protonów)
przesunięcie gęstości elektronowej () w cząsteczce na podstawnik o wysokiej elektroujemności, co wpływa na zmianę reaktywności całej cząsteczki, jak i samego podstawnika przyciągającego elektrony
Bibliografia
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa, 1985.
McMurry J., Chemia organiczna, Warszawa, 2000.
McMurry J., Chemia organiczna, Warszawa, 2016.
Danikiewicz W., Część III. Chemia organiczna, Warszawa, 2009.
Kaznowski K., CHEMIA Vademecum maturalne, Warszawa, 2016.
http://zcho.ch.pw.edu.pl/dyd_bio1b26.pdf (dostęp: 24.07.2021)