Przeczytaj
Toluen (metylobenzen) to najprostsza alkilopochodna benzenu, w której za atom wodoru podstawiona jest grupa metylowa. Jest to przykład związku alifatyczno(łańcuchowo)-aromatycznego o następującym wzorze:

Toluen zawiera zarówno część alifatyczną, jak i aromatyczną, dzięki czemu przejawia właściwości dwojakiego rodzaju. Występowanie pierścienia aromatycznego wskazuje na to, że ów związek ulega m.in. reakcjom substytucji elektrofilowej, natomiast występowanie łańcucha bocznego – substytucji rodnikowej. Co więcej, oba fragmenty – alifatyczny i aromatyczny – wpływają na siebie. Grupa metylowa oddziałuje na zmianę właściwości aromatycznych pierścienia, natomiast ten z kolei decyduje o właściwościach alifatycznych łańcucha bocznego. Przykładowo, w wyniku obecności grupy metylowej nitrowanie pierścienia zachodzi łatwiej niż w samym benzenie. I odwrotnie – halogenowanie (np. bromowanie) grupy metylowej zachodzi łatwiej w obecności pierścienia niż dla samego metanu. Dlatego należy pamiętać, że każdy fragment cząsteczki wpływa na reaktywność drugiego fragmentu, wobec całego związku.

Poniżej przedstawiono charakterystyczne reakcje dla toluenu.
Substytucja elektrofiowa w pierścieniu
Substytucja elektrofilowaSubstytucja elektrofilowa to typ reakcji chemicznej, charakterystycznej dla węglowodorów aromatycznych oraz ich pochodnych. Polega na podstawieniu atomu wodoru w pierścieniu aromatycznym drobiną o charakterze elektrofilowym (o ładunku dodatnim). Jest to możliwe dzięki oddziaływaniu chmury elektronowej pierścienia aromatycznego posiadającej ładunek ujemny z drobiną o ładunku dodatnim (z elektrofilem). Do reakcji substytucji elektrofilowej należą reakcje nitrowania, halogenowania (bromowania, chlorowania), alkilowania, acylowania czy sulfonowania.

Atomy wodoru pierścienia aromatycznego toluenu nie są równocenne chemicznie, więc w odróżnieniu od benzenu nie bez znaczenia jest to, który atom wodoru ulega podstawieniu. Grupa metylowa, należąca do grup alkilowych w reakcjach aromatycznego podstawienia elektrofilowego (substytucji elektrofilowej), silnie aktywuje pierścień, czyli wzbogaca go w elektrony. O takiej grupie mówi się wówczas jako o aktywującej lub elektrodonorowejelektrodonorowej. Tego typu grupy są podstawnikami rodzaju i kierują inne podstawniki w położenie orto i para.

W wyniku każdej reakcji substytucji elektrofilowej powstaje zatem mieszanina produktów w postaci izomerów orto i para.
Nitrowanie
Reakcja nitrowanianitrowania, czyli podstawienia za atom wodoru z pierścienia aromatycznego grupy nitrowej, zachodzi w obecności mieszaniny nitrującej, czyli stężonych kwasów: azotowego() oraz siarkowego(). Zgodnie z wpływem kierującym podstawnika metylowego, produktami reakcji nitrowania toluenu są o-nitrotoluen
(-metylo--nitrobenzen) oraz p-nitrotoluen (-metylo--nitrobenzen), czytane jako „orto-nitrotoluen” oraz „para-nitrotoluen”.

Halogenowanie
Do reakcji halogenowaniahalogenowania zalicza się m.in. bromowanie oraz chlorowanie, czyli podstawienie za atom wodoru w pierścieniu aromatycznym atomu bromu lub chloru. Reakcje zachodzą pod wpływem katalizatorów, odpowiednio i lub samego żelaza.
Dla przykładu, zgodnie z wpływem kierującym podstawnika metylowego, produktami reakcji bromowania toluenu są -bromo--metylobenzen oraz
-bromo--metylobenzen.

Alkilowanie
Reakcja alkilowaniaalkilowania to reakcja podstawienia za atom wodoru pierścienia aromatycznego dowolnej grupy alkilowej, czyli jednowartościowej grupy utworzonej przez oderwanie atomu wodoru od alkanu. Katalizatorem reakcji alkilowania jest , reagujący z dowolnym halogenkiem alkilu.
Zgodnie z wpływem kierującym podstawnika metylowego, produktami reakcji alkilowania, w poniższym przykładzie metylowania, są ,-dimetylobenzen oraz
,-dimetylobenzen.

Acylowanie
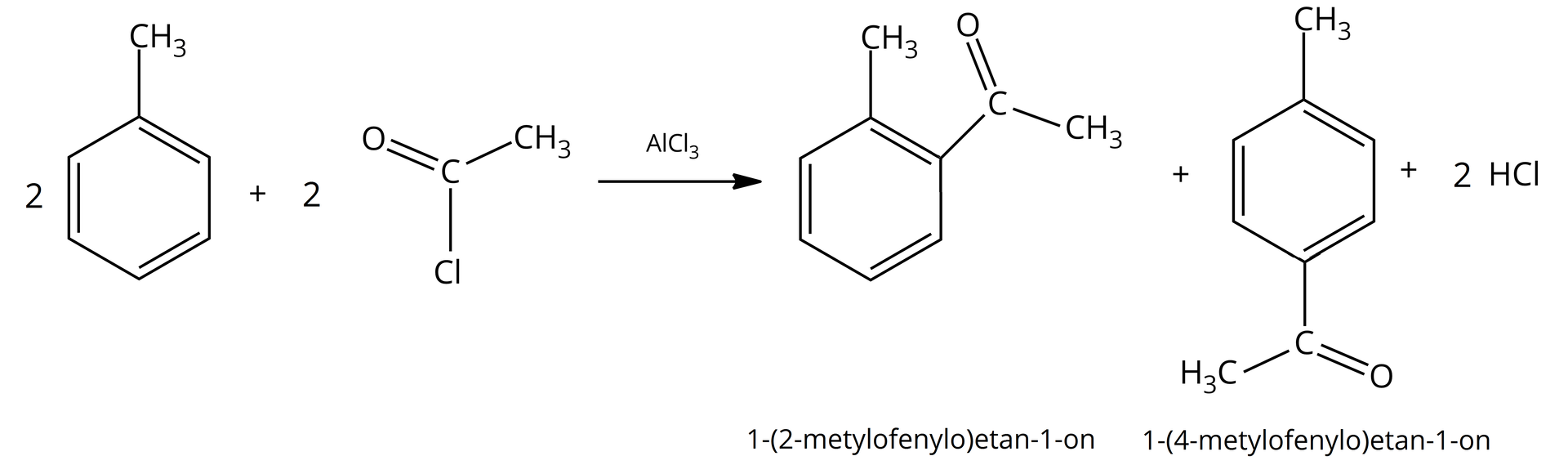
Reakcja acylowaniaacylowania to reakcja podstawienia za atom wodoru grupy acylowej, czyli , gdzie oznacza resztę węglowodorową. Otrzymuje się wówczas odpowiedni keton. Katalizatorem reakcji acylowania jest , który reaguje z halogenkiem kwasu karboksylowego – najczęściej chlorkiem kwasowym.
Zgodnie z wpływem kierującym podstawnika metylowego, produktami reakcji acylowania (w poniższym przykładzie użyto chlorku kwasu octowego) są
-(-metylofenylo)etan--on oraz -(-metylofenylo)etan--on.
Sulfonowanie
SulfonowanieSulfonowanie to reakcja podstawienia za atom wodoru grupy sulfonowej , powstającej m.in. w reakcji mieszaniny i , czyli tzw. dymiącego kwasu siarkowego(). Zgodnie z wpływem kierującym podstawnika metylowego produktami reakcji sulfonowania toluenu są kwas -metylobenzenosulfonowy oraz
-metylobenzenosulfonowy.

Hydrogenacja pierścienia
Kolejnym typem reakcji, w której uczestniczy pierścień aromatyczny, jest reakcja addycji wodoru. Toluen w odpowiednich warunkach ulega hydrogenacji, czyli uwodornieniuuwodornieniu, pod wpływem katalizatorakatalizatora – np. , lub . Taka reakcja zachodzi zgodnie z mechanizmem addycji na katalizatorze i prowadzi do powstania metylocykloheksanu.

Reakcja ta wiąże się z utratą aromatyczności produktu, należącego do grupy cykloalkanów.
Substytucja rodnikowa w łańcuchu bocznym
Substytucja rodnikowaSubstytucja rodnikowa to typ reakcji podstawienia dla nasyconych związków organicznych. Jej przebieg wiąże się z wytwarzaniem reaktywnych rodników, najczęściej pod wpływem światła (). Ogólny przebieg substytucji rodnikowej przedstawia poniższy schemat:

Grupa metylowa w cząsteczce toluenu ulega zatem reakcji substytucji wolnorodnikowej w wyniku fluorowcowania za pomocą lub w obecności światła.

W wyniku chlorowania toluenu otrzymuje się chlorofenylometan o zwyczajowej nazwie chlorek benzylu.
Utlenianie łańcucha bocznego
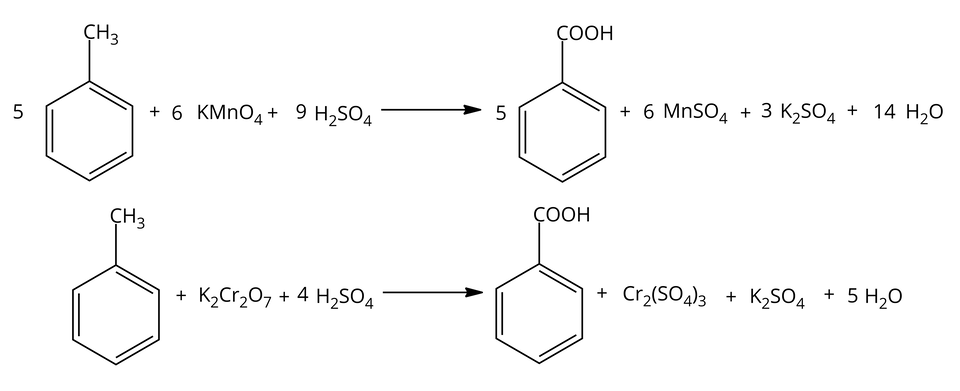
Kolejnym typem reakcji, która dotyczy łańcucha bocznego, jest jego utlenianieutlenianie za pomocą silnego utleniaczautleniacza, np. , czy . Utlenianie toluenu prowadzi do otrzymania kwasu benzoesowego (kwasu benzenokarboksylowego). ReduktoremReduktorem w tej reakcji jest natomiast sama cząsteczka toluenu.

Pozostałe produkty reakcji zależą od użytego utleniacza oraz warunków prowadzenia reakcji, tak jak pokazano na poniższych przykładach, gdzie utleniaczem jest np. manganian() potasu oraz dichromian() potasu w środowisku kwasowym.
Słownik
podstawniki, które „dostarczają” elektrony do pierścienia aromatycznego (np. , , , ); podstawnik ulega sprzężeniu z pierścieniem aromatycznym
reakcja substytucji (podstawienia) zachodząca najczęściej dla związków aromatycznych, w której czynnikiem atakującym jest elektrofil
indywiduum chemiczne obdarzone ładunkiem dodatnim (w reakcji bromowania jest to , w reakcji nitrowania , w reakcji chlorowania , w reakcji metylowania itd.)
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu grupy nitrowej do cząsteczki toluenu, w wyniku podstawienia atomów wodoru w pozycjach orto i para
reakcja substytucji elektrofilowej, polegająca na wprowadzaniu atomu fluorowca (najczęściej lub ) do cząsteczki toluenu, w wyniku podstawienia atomów wodoru w pozycjach orto i para
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu do cząsteczki toluenu grupy sulfonowej , w wyniku podstawienia atomów wodoru w pozycjach orto i para
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu do cząsteczki toluenu grupy alkilowej , w wyniku podstawienia atomów wodoru w pozycjach orto i para
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu do cząsteczki toluenu grupy alkilowej , w wyniku podstawienia atomów wodoru w pozycjach orto i para
uwodornianie, hydrogenizacja, hydrogenacja, wodorowanie, hydrogenoliza; reakcja redukcji polegająca na przyłączaniu wodoru do danego związku chemicznego
reakcja substytucji (podstawienia) zachodząca z wytworzeniem rodników; charakterystyczna dla alkanów
reakcja, w której dochodzi do przeniesienia jednego lub więcej elektronów od atomu, jonu lub cząsteczki donora (czyli reduktora) do akceptora (czyli utleniacza)
cząsteczka lub jon, który w reakcjach redoks przyjmuje elektrony, zmniejszając tym samym swój stopień utlenienia
cząsteczka lub jon, który w reakcjach redoks oddaje elektrony, zwiększając swój stopień utlenienia
substancja chemiczna, którą dodaje się do układu w celu zwiększenia szybkości reakcji chemicznej; katalizator nie zużywa się podczas trwania reakcji
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
McMurry J., Chemia organiczna, Warszawa 2000.
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa 2000.