Przeczytaj
Podział reakcji chemicznych w chemii organicznej opiera się na mechanizmie, wg którego dana reakcja zachodzi. W przypadku reakcji wieloetapowych, o mechanizmie decyduje ten zachodzący najwolniej. Z tego powodu istotne jest rozpoznawanie czynników, które atakują substraty z wytworzeniem nietrwałego stanu przejściowego.
Reakcje w chemii organicznej są klasyfikowane na podstawie czynnika atakującego substrat. Można wyróżnić rodniki (posiadają niesparowany elektron). Mogą one atakować niepolarne fragmenty cząsteczki.
Spośród czynników, działających na polarne fragmenty cząsteczki, można wyróżnić:
nukleofile – atakują dodatnio spolaryzowane fragmenty;
elektrofile – atakują ujemnie spolaryzowane fragmenty.

Nukleofile jako czynniki powodujące zachodzenie reakcji chemicznych
Oprócz reaktywnych rodników, czyli atomów bądź fragmentów cząsteczek, które posiadają niesparowany elektron i mogą inicjować reakcje chemiczne w wielu miejscach cząsteczki substratu, w chemii organicznej występują także czynniki inicjujące reakcje o charakterze jonowym – nukleofile i elektrofile.
Jeśli atom węgla tworzy wiązanie z atomem o większej elektroujemności, wówczas pojawiający się na atomie węgla cząstkowy ładunek dodatni powoduje podatność na atak nukleofilanukleofila.
Określenie „nukleofil” dotyczy cząsteczki lub jonu, dysponującego wolną parą elektronową, która może atakować dodatnio spolaryzowany atom węgla (określany jako centrum elektrofilowe), tworząc tym samym z nią wiązanie. Ze względu na fakt, że w tym procesie następuje przekazanie wolnej pary elektronowej od nukleofila do elektrofilowego atomu węgla, można określić taki proces jako reakcja kwasowo‑zasadowa w ujęciu teorii Lewisa.
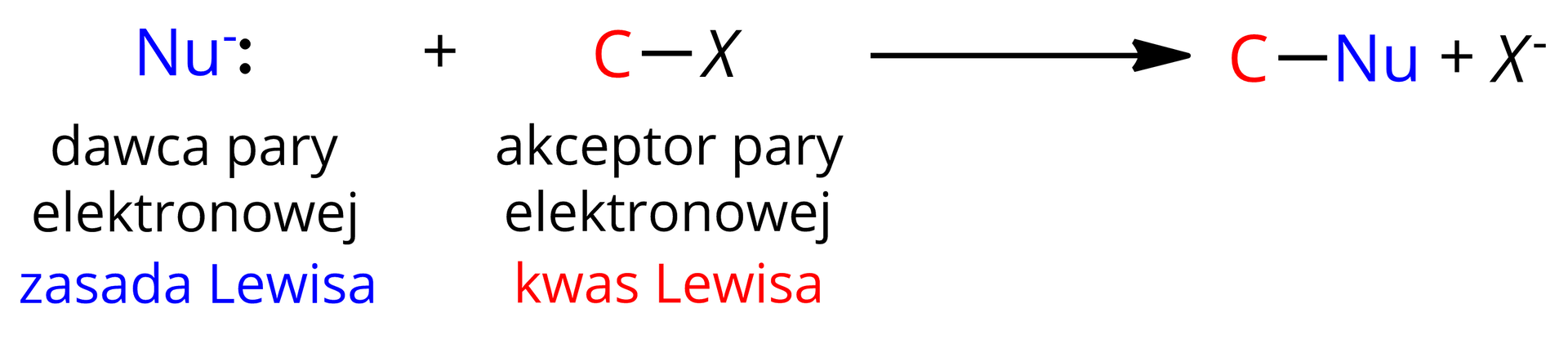
W przypadku fragmentów, które zawierają dużą gęstość elektronową – np. wiązania wielokrotne lub pierścienie aromatyczne – czynnikami powodującymi zachodzenie reakcji chemicznych są elektrofile.
Charakter nukleofilowy
Charakter nukleofilowy określa się jako nukleofilowość. W ujeciu teorii Lewisa jest to wielkość związana z mocą zasady.
Dla cząsteczek/jonów, o analogicznej budowie, rośnie wraz ze wzrostem ładunku ujemnego.
Nukleofilowość rośnie wraz ze wzrostem charakteru zasadowego.
Słownik
(łac. nucleus „jądro”, gr. philia „lubić”), drobina (cząsteczka lub anion), dysponująca co najmniej jedną wolną parą elektronową; nukleofil – ze względu na posiadanie dużej gęstości elektronowej na jednym z atomów – będzie atakował centra spolaryzowane dodatnio
reakcja substytucji, zachodząca z udziałem nukleofila; w trakcie tej reakcji następuje najpierw odłączenie wymienianej grupy i utworzenie przejściowego karbokationu, który zawiera trójwiązalny atom węgla, obdarzony ładunkiem dodatnim, a kolejnym etapem jest przyłączenie nukleofila, prowadzące do utworzenia końcowego produktu

reakcja substytucji zachodząca z udziałem nukleofila; w trakcie tej reakcji pojawia się oddziaływanie elektrofilowego atomu węgla z przychodzącym nukleofilem, połączone z osłabianiem wiązania węgiel‑grupa opuszczająca; w odróżnieniu od reakcji SIndeks dolny NN1, stan przejściowy jest charakteryzowany przez obecność atomu węgla, otoczonego przez pięć atomów sąsiadujących z nim: trzy, do których tworzy wiązania, oraz dwa częściowo związane; kolejnym etapem jest osłabienie wiązania między elektrofilowym atomem węgla a grupą opuszczającą, połączone ze stabilizacją wiązania pomiędzy elektrofilowym atomem węgla a przychodzącym nukleofilem

rozpuszczalnik, który może wymieniać protony ze względu na obecność wiązań kowalencyjnych spolaryzowanych pomiędzy atomami wodoru a innymi atomami; w przypadku obecności wiązań lub , taki rozpuszczalnik może tworzyć wiązania wodorowe między swoimi cząsteczkami, a także z cząsteczkami innych substancji posiadających odpowiedni fragment molekularny; przykładami rozpuszczalników protycznych są m.in. woda, alkohole, aminy pierwszo- i drugorzędowe, kwasy karboksylowe
rozpuszczalnik, który nie może wymieniać protonów ze względu na brak wiązań kowalencyjnych spolaryzowanych pomiędzy atomami wodoru a innymi atomami; zazwyczaj cząsteczki takich związków posiadają wiązania ; przykładami rozpuszczalników aprotycznych są m.in. węglowodory, aminy trzeciorzędowe, nitryle (związki zawierające grupę połączoną z atomem węgla)
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
McMurry J., Chemia Organiczna, Warszawa 2003.