Przeczytaj
Co łączy, a co różni alkohole i fenole?
AlkoholeAlkohole i fenolefenole należą do hydroksylowych pochodnych węglowodorów. Ich cechą wspólną jest występowanie w cząsteczce grupy hydroksylowej (grupy wodorotlenowej) . W cząsteczkach alkoholi grupa ta łączy się z tetraedrycznym atomem węgla (o hybrydyzacji orbitali walencyjnych ), natomiast w cząsteczkach fenoli – z trygonalnym atomem węgla pierścienia aromatycznego (o hybrydyzacji orbitali walencyjnych ).
Właściwości fizyczne
Wraz ze wzrostem długości łańcucha węglowodorowego alkoholu, maleje jego lotność oraz rozpuszczalność w wodzie. Im dłuższy łańcuch węglowodorowy, tym większa masa alkoholu, a tym samym potrzebne jest więcej energii, aby zmienić stan skupienia. Ponadto, im więcej atomów węgla posiada alkohol, tym mniejszy jest efekt obecności tlenu, co prowadzi do osłabienia wiązania w .
Fenole stosunkowo łatwo ulegają reakcji substytucji elektrofilowej, której produkty odznaczają się odmiennymi właściwościami. Przykładowo -metylofenol charakteryzuje się mniejszą rozpuszczalnością w wodzie niż fenol, a ,,-trinitrofenol to związek występujący w postaci żółtych kryształów, w odróżnieniu od przezroczystych kryształów fenolu.
Właściwości fizyczne alkoholi zmieniają się wraz z ilością atomów węgla w cząsteczce. Im większa ich liczba w łańcuchu, tym większa masa molowa, a tym samym mniej lotny homolog, co prowadzi do konieczności dostarczenia większej energii, np. w celu doprowadzenia odpowiedniego alkoholu o dłuższym łańcuchu do wrzenia. Ponadto wraz z większą liczbą atomów węgla w łańcuchu zmniejsza się hydrofilowość rozpatrywanej cząsteczki – a zatem obniża się rozpuszczalność w rozpuszczalnikach polarnych. Wpływ na ich właściwości fizyczne ma również rozgałęzienie łańcucha węglowodorowego. Cząsteczki o liniowo połączonych atomach węgla w łańcuchu będą wymagały do dostarczenia większej energii w celu doprowadzenia ich do temperatury wrzenia. Przykładowo czterowęglowy alkohol tert-butylowy (-metylopropan--ol: - pod ciśnieniem ) posiada mniejszą temperaturę wrzenia niż jego izomer alkohol n-butylowy (butan--ol: - pod ciśnieniem ). W przypadku fenoli właściwości fizyczne zmieniają się wraz z rodzajem występujących w pierścieniu aromatycznym podstawników i z tego względu mogą być bardzo zróżnicowane. Poniżej przedstawiono porównanie tych właściwości na przykładzie typowych przedstawicieli obu grup, czyli etanolu i fenolu.
Występowanie grupy hydroksylowej w cząsteczkach alkoholi i fenoli nie powoduje ich podobieństwa we właściwościach fizycznych. Alkohole i fenole wykazują duże różnice pod kątem charakterystyki fizycznej, ze względu na różną budowę. Alkohole to pochodne węglowodorów alifatycznych, a fenole – pochodne węglowodorów aromatycznych. Należą więc one do grup o odmiennych właściwościach fizykochemicznych.
Właściwości chemiczne
Alkohole | Fenole |
|---|---|
Wzory podstawowe | |
Dysocjacja elektrolityczna | |
brak dysocjacji 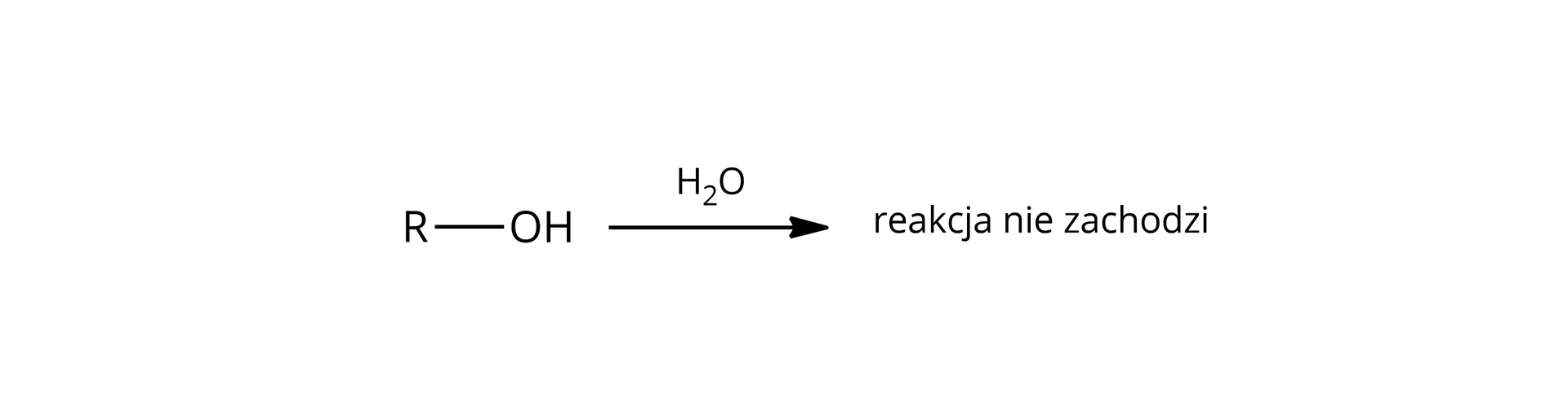 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tak 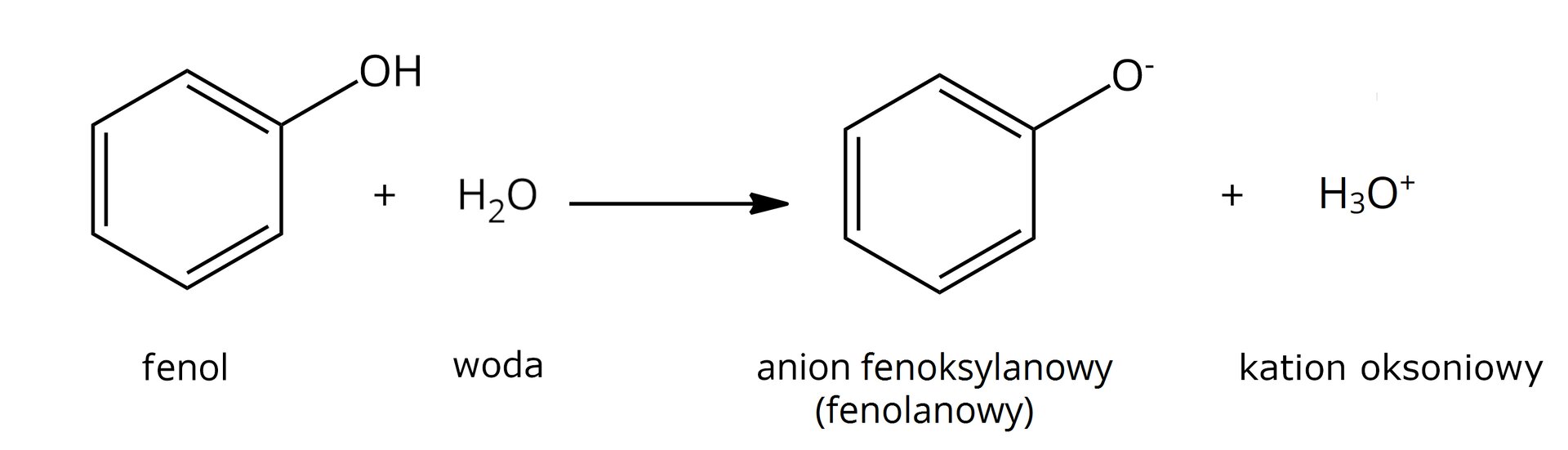 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Odczyn wodnego roztworu | |
Alkohole nie ulegają dysocjacji elektrolitycznej pod wpływem wody – odczyn ich wodnego roztworu jest więc obojętny. | Fenole to słabe kwasy, które ulegają dysocjacji elektrolitycznej pod wpływem wody. Odczyn ich wodnych roztworów jest kwasowy. |
Przewodnictwo wodnego roztworu | |
brak, ze względu na brak jonów | tak, ze względu na występowanie jonów w roztworze |
Reakcja z metalem aktywnym | |
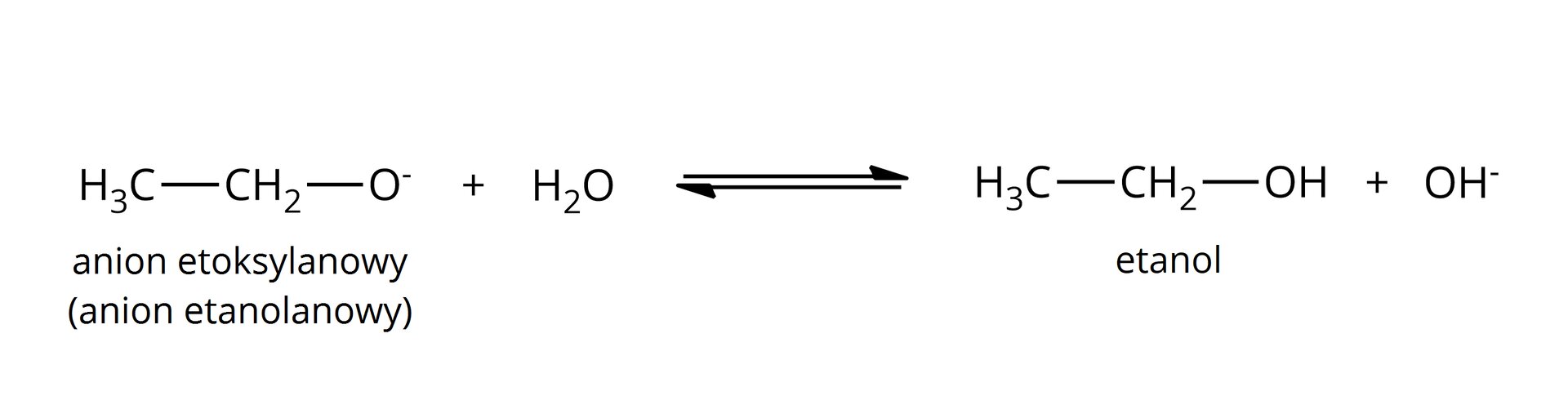
tak, powstają alkoholany: 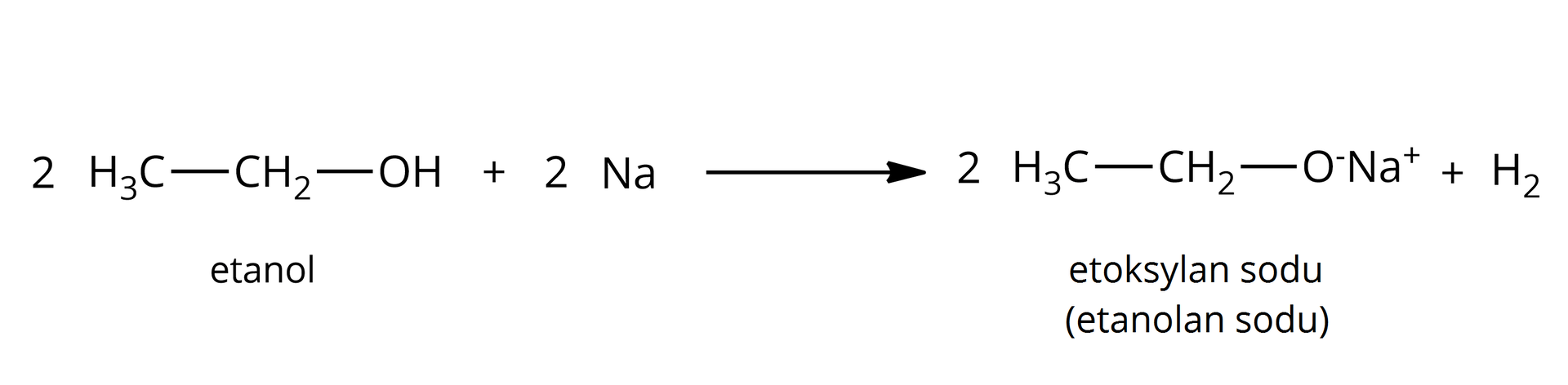 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tak, powstają fenolany: 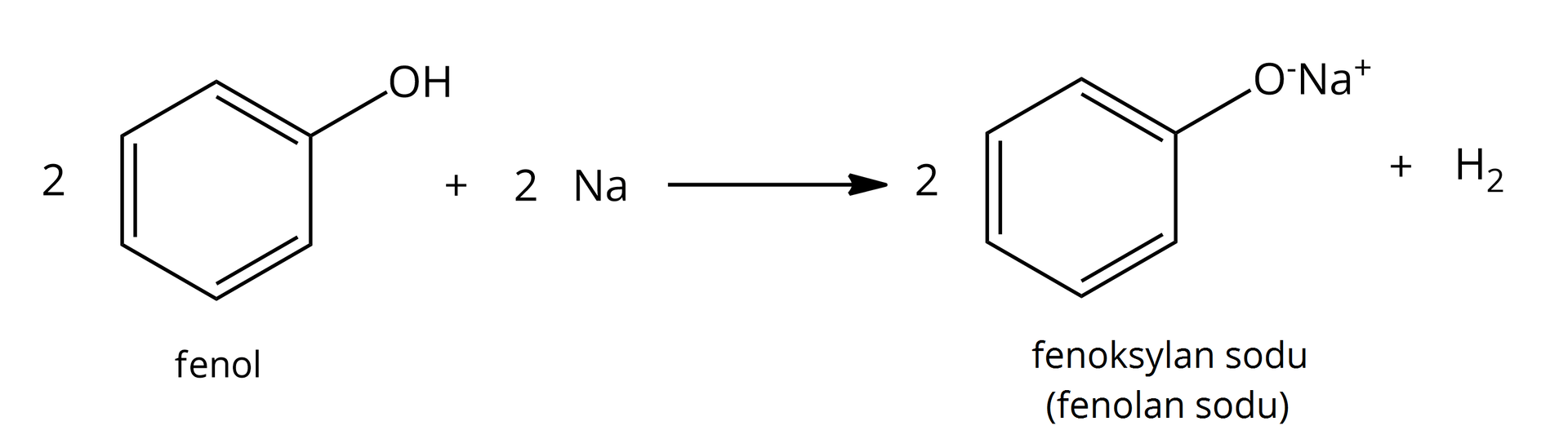 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Warto zaznaczyć, że w zarówno alkoholany, jak i fenolany charakteryzują się nowym wiązaniem jonowym pomiędzy atomami tlenu oraz metalu aktywnego. W wyniku reakcji wydziela się bezbarwny gaz – wodór. | |
 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 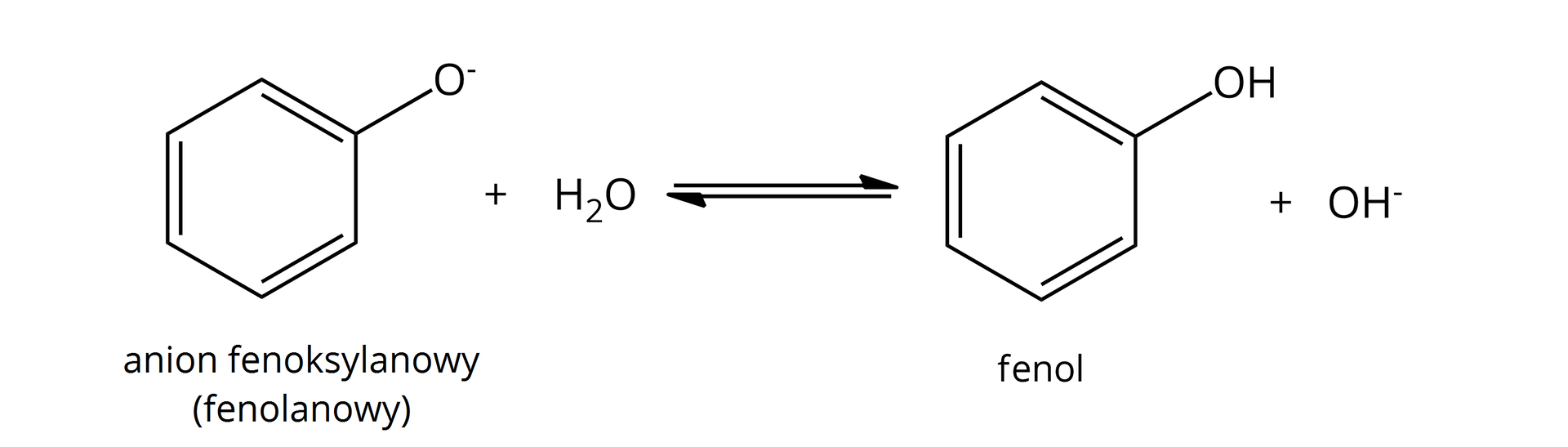 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Reakcja z mocną zasadą | |
nie 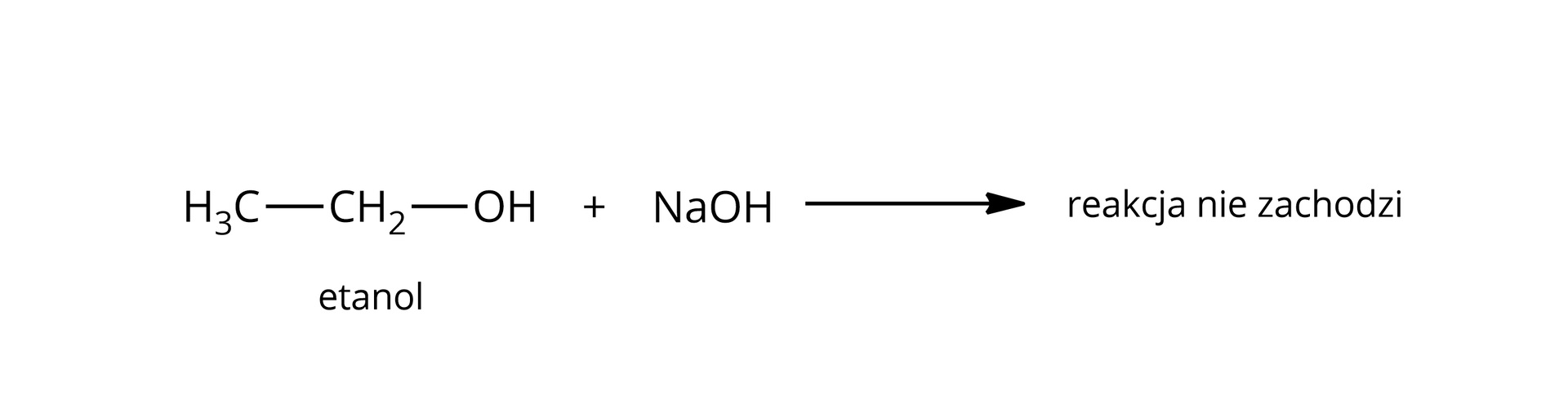 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tak 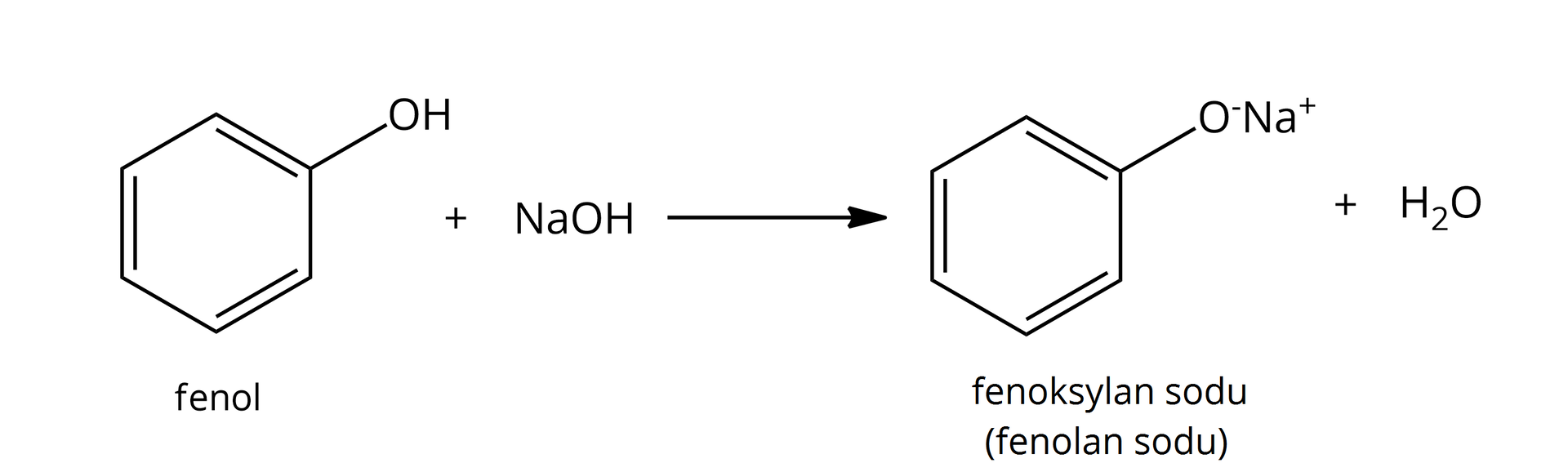 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Charakter chemiczny | |
właściwości obojętne | właściwości kwasowe – reagują z metalami aktywnymi, jak i zasadami |
Reakcja utleniania | |
tak – produkty zależą od rodzaju alkoholu i utleniacza: 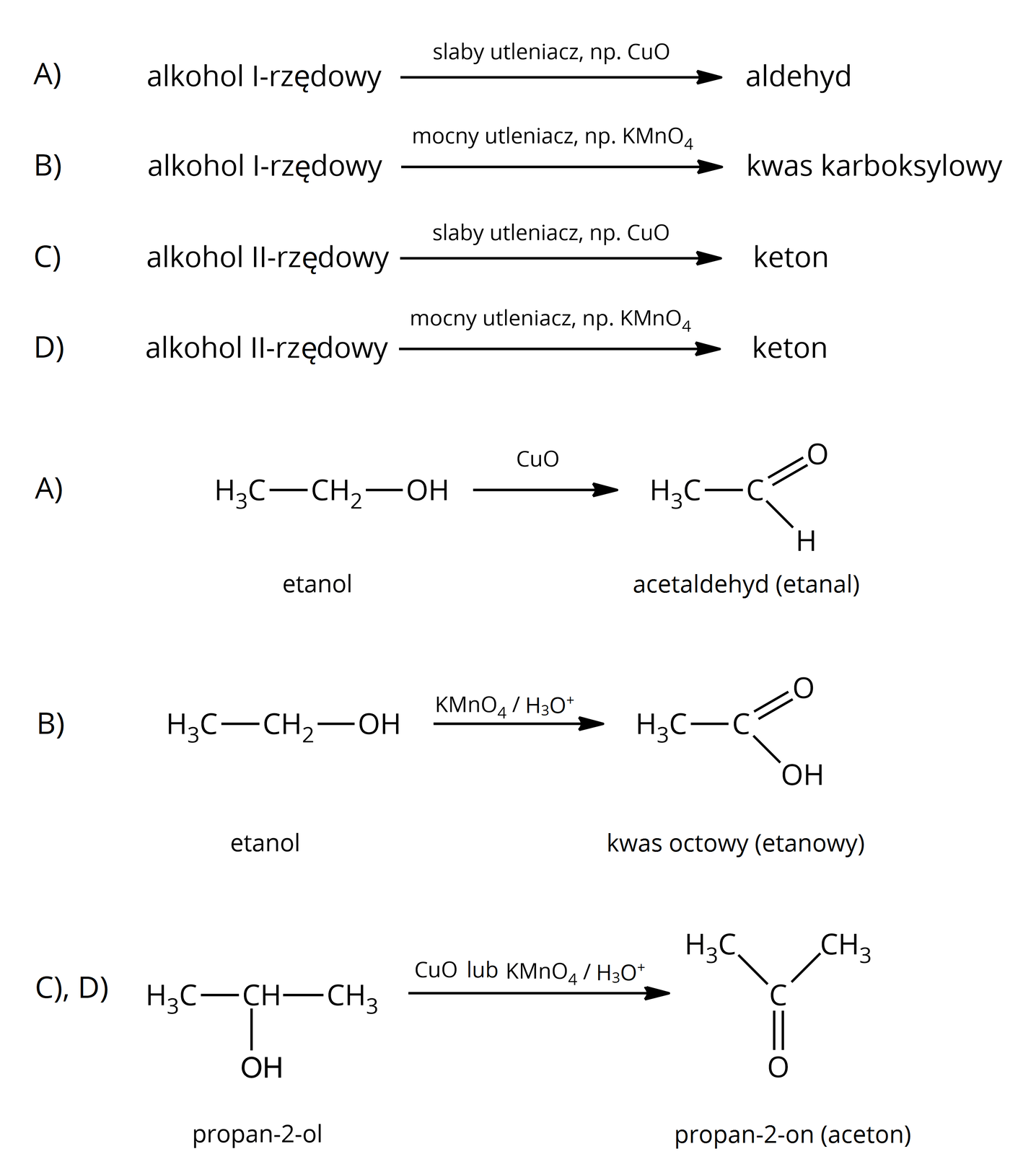 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tak – produkty zależą od rodzaju fenolu i utleniacza: 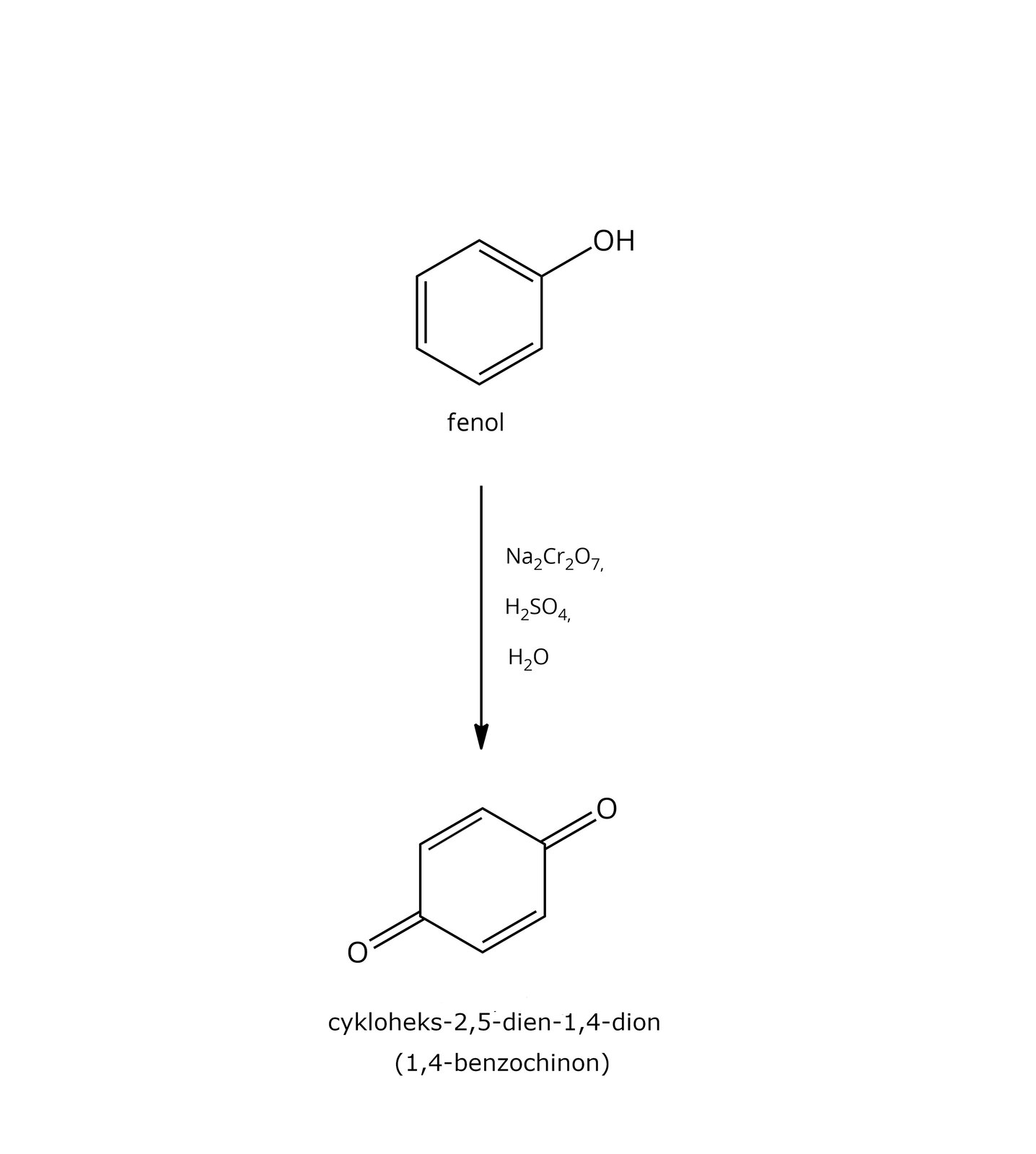 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Reakcja estryfikacji | |
tak 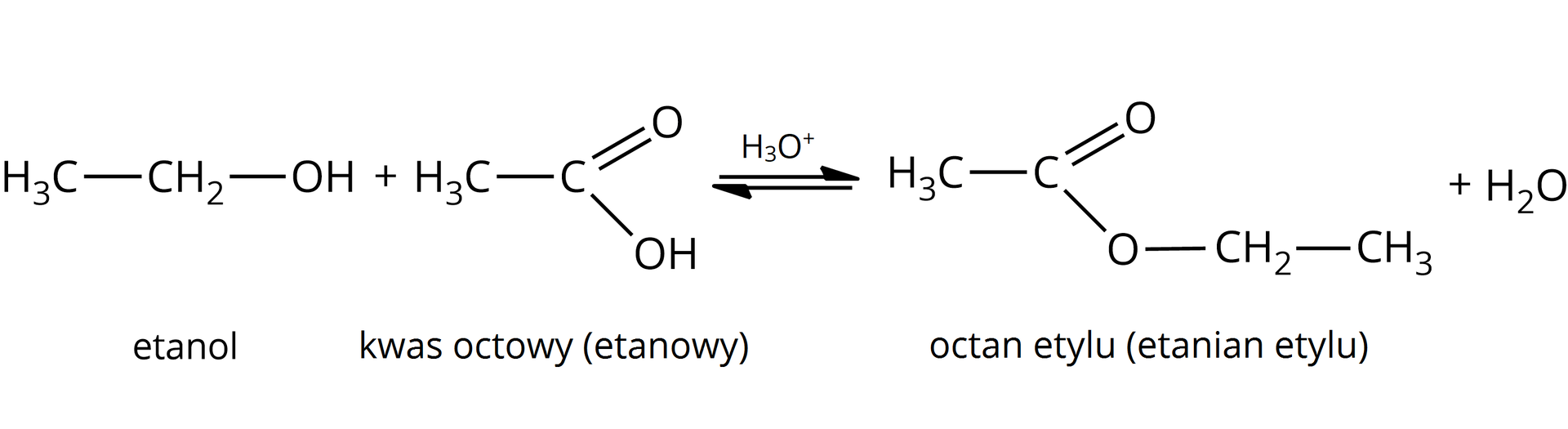 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tak 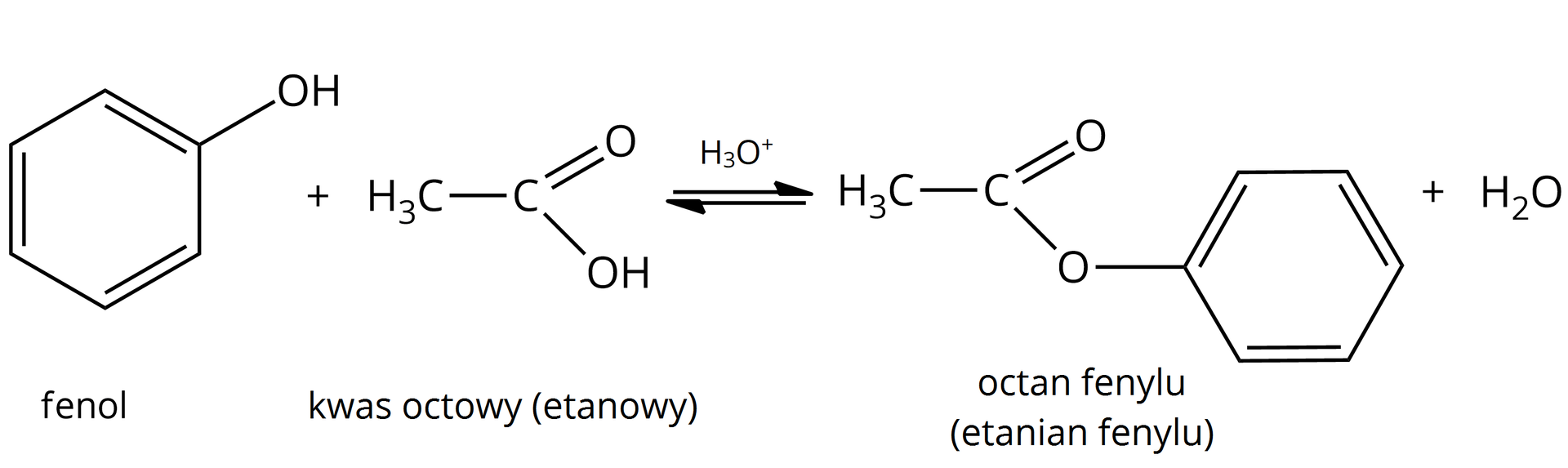 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Reakcje z kwasem azotowym | |
tak – reakcja estryfikacji: 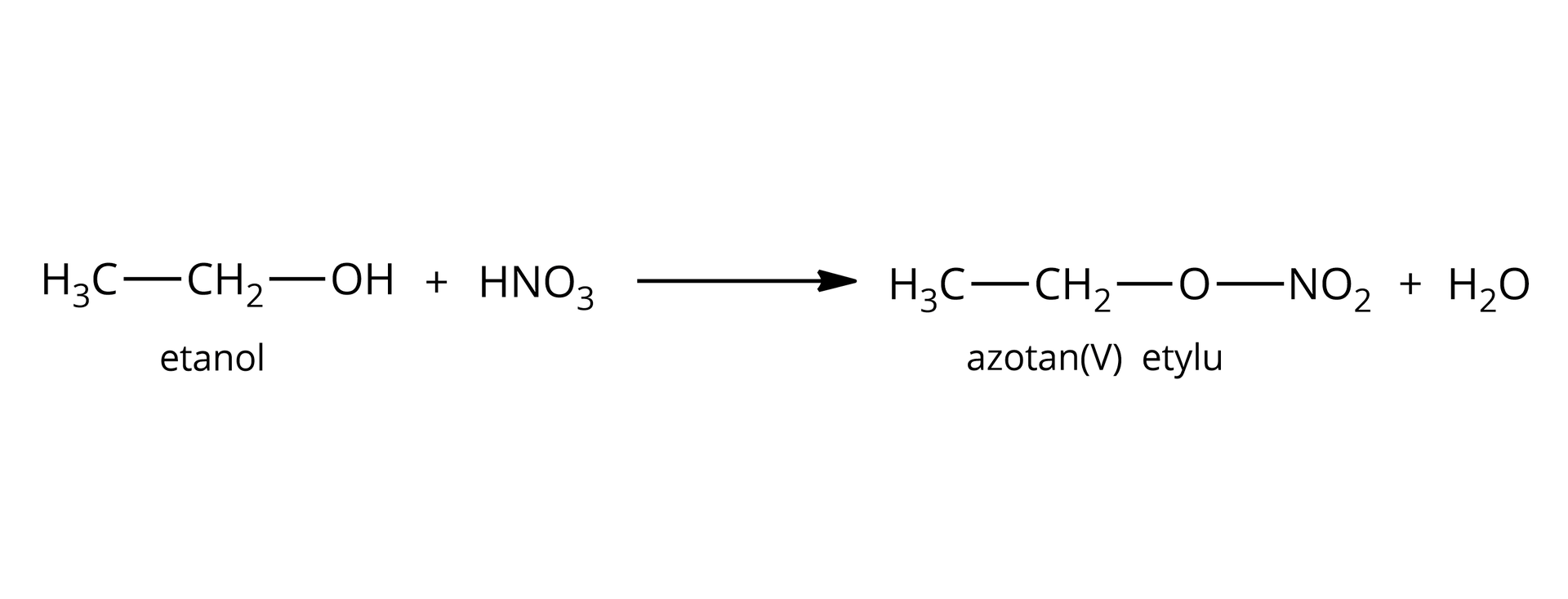 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | tak – nitrowanie pierścienia aromatycznego: 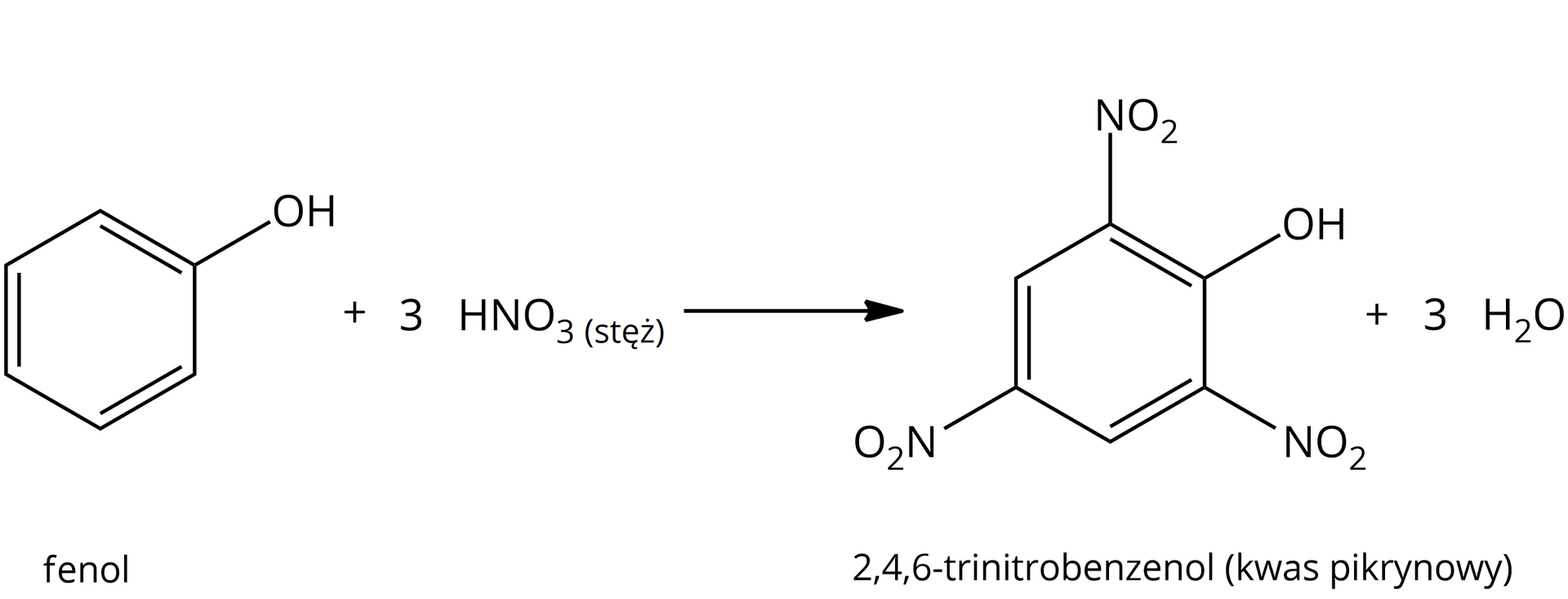 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Reakcja z chlorkiem żelaza | |
nie | tak, jest to reakcja charakterystyczna na wykrycie ugrupowań fenolowych; w wyniku reakcji otrzymuje się klarowny, fioletowy roztwór: 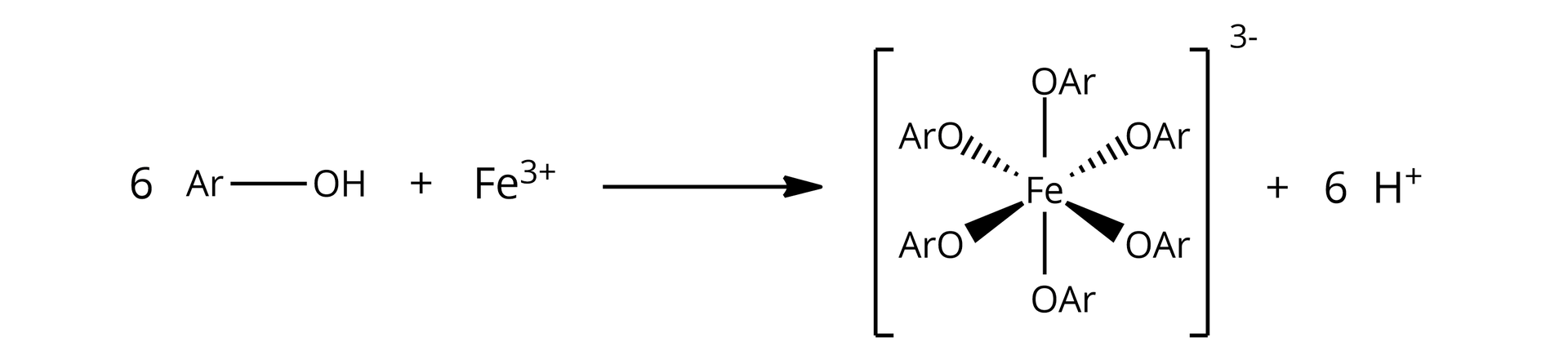 Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. |
Zastosowanie
- Przemysł farmaceutyczny (produkcja leków, wyciągów ziołowych, syropów).
- Przemysł kosmetyczny (baza dla wielu kosmetyków, na przykład kremy do rąk, płyny po goleniu, perfumy, wody toaletowe, płyny do płukania jamy ustnej itp.).
- Przemysł spożywczy (napoje alkoholowe, substancje słodzące, na przykład sorbitol).
- Przemysł chemiczny (rozpuszczalniki, środki odkażające, płyny do chłodnic, farby, lakiery).
- Przemysł farmaceutyczny (produkcja leków – aspiryna, środki bakteriobójcze; środki wykrztuśne w syropach).
- Przemysł chemiczny (żywice fenolowo-formaldehydowe (tworzywa sztuczne), detergenty, herbicydy, barwniki).
Słownik
(arab. al‑kuhl „delikatny proszek”) związki organiczne, pochodne węglowodorów, których cząsteczki zawierają grupę hydroksylową zamiast atomu wodoru związanego w związku macierzystym z atomem węgla grupy alkilowej lub cykloalkilowej
związki organiczne, mono-, di- i polihydroksylowe pochodne benzenu oraz alkilobenzenów, których cząsteczki zawierają grupy hydroksylowe () związane z atomem węgla pierścienia benzenowego
zmiana objętości przy mieszaniu niektórych rozpuszczających się wzajemnie cieczy, na przykład wody i etanolu; kontrakcję objętości uwzględnia się w przemyśle spirytusowym w procesach technologicznych oraz przy obliczaniu wydajności produkcji; przy dodawaniu wody do etanolu (spirytusu) powstaje nie , lecz roztworu; wynika z licznych wiązań wodorowych, które asocjują cząsteczki wody i alkoholu
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.