Przeczytaj
Reakcja redoks to reakcja chemiczna, w trakcie której dochodzi do przeniesienia elektronów pomiędzy odpowiednimi atomami, czemu towarzyszą zmiany stopni utlenieniastopni utlenienia atomów.
Równanie reakcji redoks:
Reakcja redoks składa się z dwóch reakcji połówkowych: reakcji utleniania i redukcji. Reakcja utleniania polega na oddawaniu elektronów przez atomy, w wyniku czego dochodzi do podwyższenia stopnia utlenienia. Atom podnoszący swój stopień utlenienia pełni rolę reduktora – .
Równanie reakcji utleniania:
Reakcja redukcji polega na przyjmowaniu elektronów przez atom, dzięki czemu dochodzi do obniżenia stopnia utlenienia. Taki z kolei atom nazywany jest utleniaczemutleniaczem – .
Równanie reakcji redukcji:
gdzie:
– forma zredukowana;
– forma utleniona;
– liczba elektronów biorąca udział w reakcji.
Jak przewidzieć przebieg reakcji redoks?
Znając wartości potencjałów standardowych półogniwpotencjałów standardowych półogniw, można przewidzieć przebieg (kierunek) reakcji redoksreakcji redoks. Potencjały standardowe półogniwpółogniw są zebrane w tablicach fizykochemicznych.
Im bardziej ujemny potencjał standardowy półogniwa, tym postać zredukowana jest silniejszym reduktoremreduktorem, a więc chętniej się utlenia (układ chętniej oddaje elektrony).
Im bardziej dodatni potencjał standardowy półogniwa, tym postać utleniona jest silniejszym utleniaczem – łatwiej dochodzi do reakcji redukcjiredukcji (układ chętniej przyjmuje elektrony).
Oznacza to, że w każdej reakcji chemicznej musi zostać spełniony warunek:
Innymi słowy: znajomość wartości potencjałów standardowych półogniw różnego rodzaju pozwala na przewidywanie:
czy dana reakcja utlenienia‑redukcji zajdzie w rzeczywistości (w warunkach standardowych);
jaki będzie kierunek reakcji chemicznej (w warunkach standardowych).
Poza tym im większa jest różnica potencjałów standardowych półogniw, tym bardziej prawdopodobna jest dana reakcja chemiczna.
Jak będzie przebiegała reakcja redoks, w której biorą udział atomy żelaza i srebra? Zapisz równanie reakcji utlenianiautleniania i redukcji. Podaj reduktor i utleniacz.
Podane są następujące potencjały standardowe półogniw:
Korzystając z podanych potencjałów standardowych półogniw, przewidujemy przebieg reakcji redoks. Wiemy, że potencjał utleniacza jest większy od potencjału reduktora, a więc:
postać utleniona srebra () będzie przyjmowała elektrony, czyli się redukowała – utleniaczem będzie ;
postać zredukowana żelaza () będzie oddawała elektrony, czyli się utleniała – reduktorem będzie .
Reakcja utleniania:
Reakcja redukcji:
Liczba elektronów oddanych przez reduktor i przyjętych przez utleniacz musi być jednakowa, dlatego należy dokonać bilansu elektronowo‑jonowego. W tym przypadku wszystkie elementy równania reakcji redukcji należy pomnożyć przez 2.
Bilans elektronowo‑jonowy:
Następnie dodajemy do siebie stronami równanie utleniania i redukcji. Przebieg reakcji redoks jest następujący:
Na czym polega reguła zegara?
Przebieg reakcji redoks można także przewidzieć, korzystając z reguły zegara na podstawie z poniższego schematu.
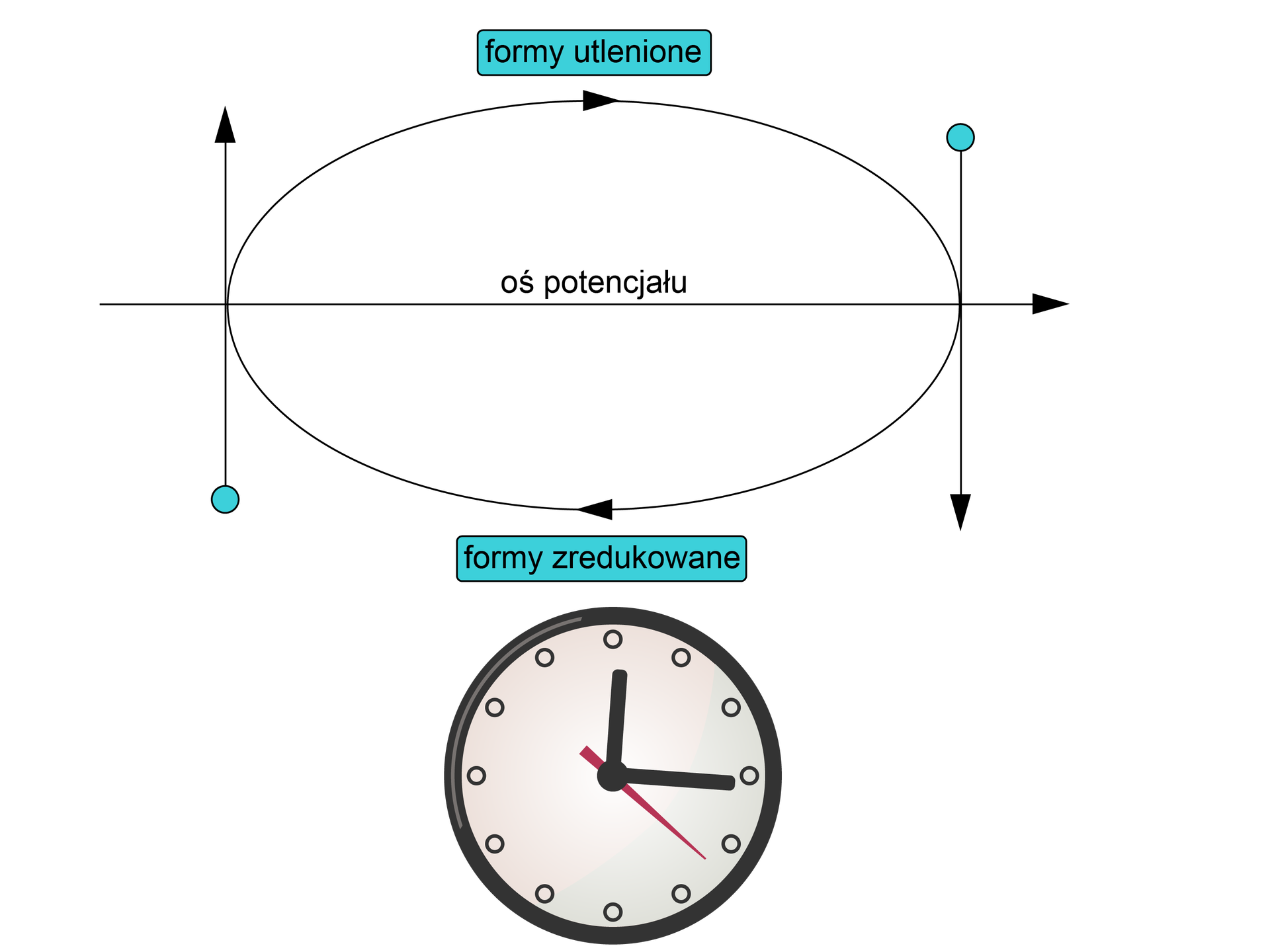
Układanie schematu należy rozpocząć od narysowania osi liczbowej, na której zaznacza się wartości potencjałów standardowych półogniw. Do miejsc zaznaczenia wartości potencjałów rysuje się proste prostopadłe. Nad osią należy zapisać formy utlenione, a pod osią formy zredukowane. Strzałki oznaczające kierunek przebiegu reakcji, zgodnie z ruchami wskazówek zegara, wskazują, że forma musi w trakcie reakcji przekształcić się w formę , a forma w formę .
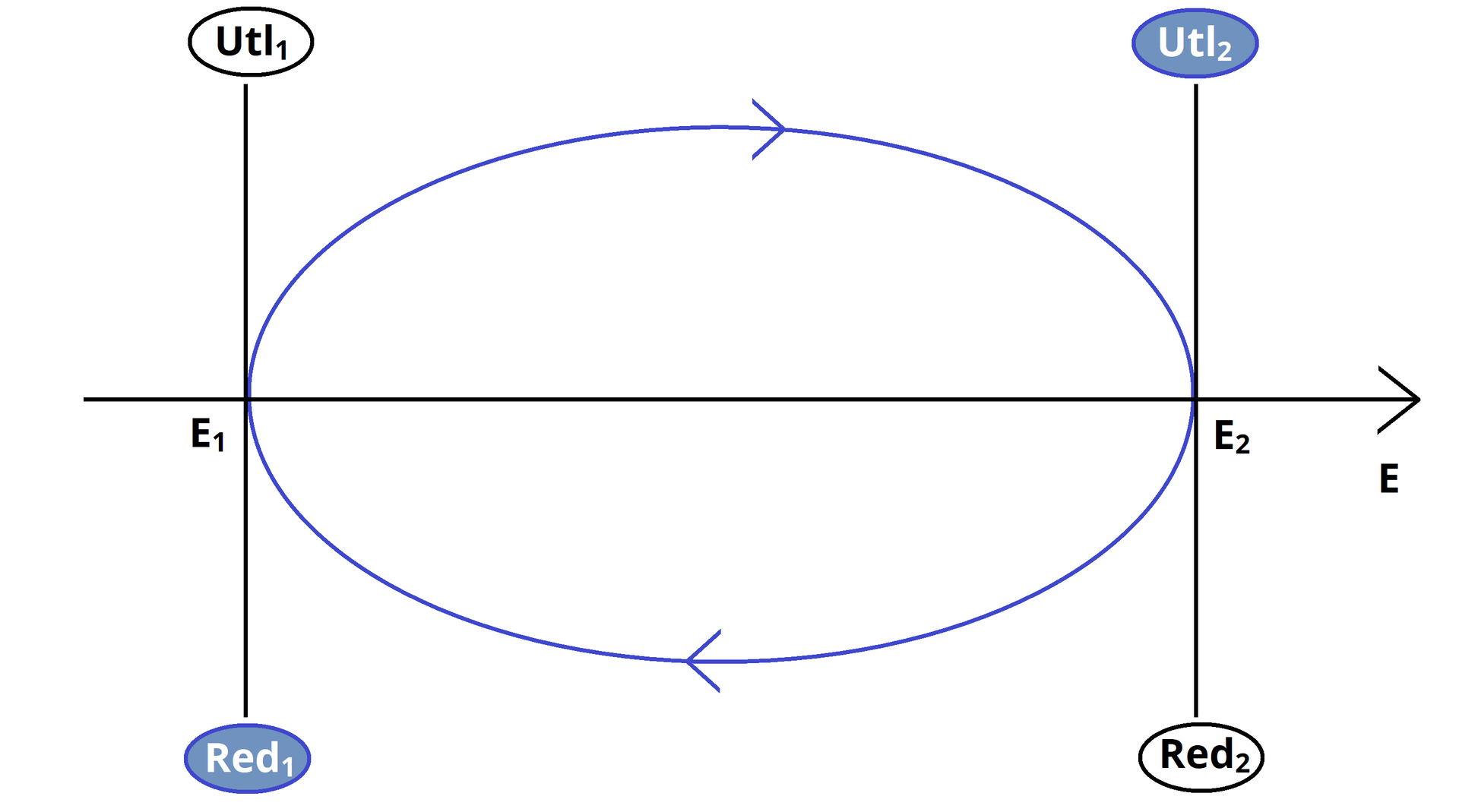
Przebieg reakcji redoks jest następujący:
Jak będzie przebiegała reakcja redoks, w której biorą udział atomy miedzi i srebra? Rozwiązując zadanie, skorzystaj z reguły zegara.
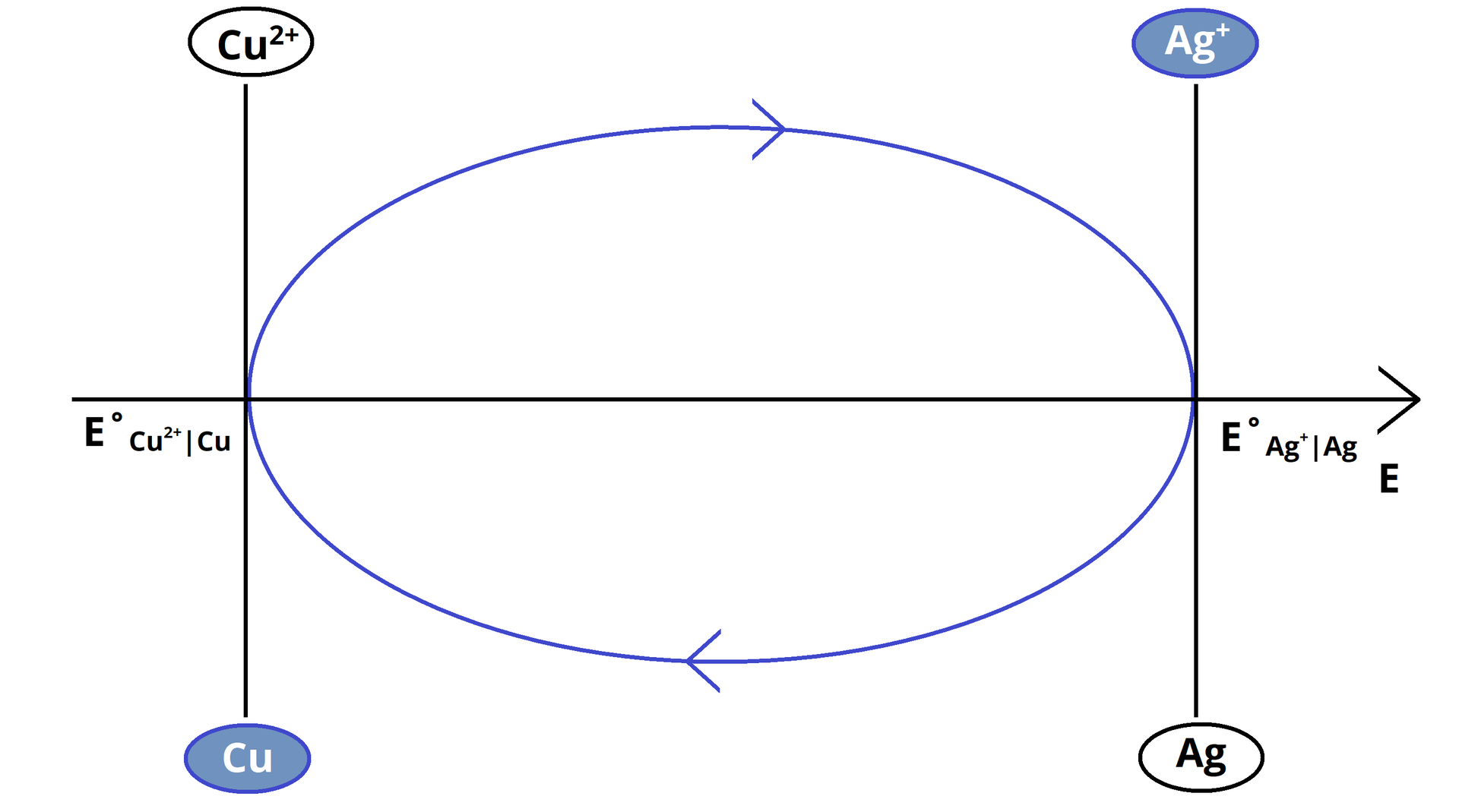
Przebieg reakcji redoks (po uwzględnieniu bilansu elektronowo‑jonowego):
Reguła zegara pozwala przewidzieć przebieg reakcji redoks, jednak nie uwzględnia współczynników stechiometrycznych. Należy więc samemu zbilansować równanie reakcji tak, aby po prawej i lewej stronie równania reakcji liczba moli danej substancji oraz ładunki były równe.
Potencjały standardowe półogniw są zebrane w tablicach fizykochemicznych.
półogniwo | równanie reakcji przebiegającej na półogniwie | [V] |
|---|---|---|
-3,04 | ||
-2,93 | ||
-2,91 | ||
-2,84 | ||
-2,71 | ||
-2,36 | ||
-1,97 | ||
-1,66 | ||
-1,18 | ||
-0,83 | ||
-0,76 | ||
-0,74 | ||
-0,44 | ||
-0,40 | ||
-0,28 | ||
-0,23 | ||
-0,15 | ||
-0,14 | ||
-0,13 | ||
-0,04 | ||
0,00 | ||
+0,07 | ||
+0,15 | ||
+0,15 | ||
+0,22 | ||
+0,27 | ||
+0,34 | ||
+0,40 | ||
+0,52 | ||
+0,54 | ||
+0,77 | ||
+0,80 | ||
+0,85 | ||
+1,09 | ||
+1,22 | ||
+1,23 | ||
+1,33 | ||
+1,36 | ||
+1,50 | ||
+1,51 | ||
+1,51 | ||
+1,72 | ||
+1,78 | ||
+1,92 | ||
+2,87 |
Tabela potencjałów standardowych półogniw w temperaturze 25°C.
Indeks dolny Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz L. Jones, P. Atkins, Chemia ogólna: cząsteczki, materia, reakcje, tłum. J. Kuryłowicz, Warszawa 2012. Indeks dolny koniecNa podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz L. Jones, P. Atkins, Chemia ogólna: cząsteczki, materia, reakcje, tłum. J. Kuryłowicz, Warszawa 2012.
Słownik
potencjał półogniwa, w którym metal zanurzony jest w roztworze zawierającym jony potencjałotwórcze o stężeniu 1 , a gazy są pod ciśnieniem 1013 hPa w temperaturze 298 K (25°C), mierzony względem standardowego półogniwa wodorowego
zbudowane z przewodnika elektronowego, który jest zanurzony w przewodniku jonowym (najczęściej to roztwór odpowiedniego elektrolitu)
reakcja chemiczna, w której dochodzi do zmiany stopni utlenienia atomów pierwiastków chemicznych
przyjmowanie elektronów przez jony lub atomy pierwiastków, w wyniku czego dochodzi do obniżenia stopnia utlenienia
atom pierwiastka podwyższający swój stopień utlenienia (utleniający się)
ładunek, jaki zgromadziłby się na atomie danego pierwiastka wchodzącego w skład związku chemicznego, przy założeniu, że wszystkie wiązania chemiczne w związku mają charakter wiązań jonowych
atom pierwiastka obniżający swój stopień utlenienia (redukujący się)
oddawanie elektronów przez jony lub atomy pierwiastków, w wyniku czego dochodzi do podwyższenia stopnia utlenienia
złożone z blaszki platynowej Pt, pokrytej czernią platynową, zanurzonej w roztworze zawierającym jony o stężeniu 1 oraz omywanej gazowym wodorem pod ciśnieniem 1013 hPa w temperaturze 298 K
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, tłum. Jan Kuryłowicz, Warszawa 2012.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.