Przeczytaj
Reakcje utleniania‐redukcji
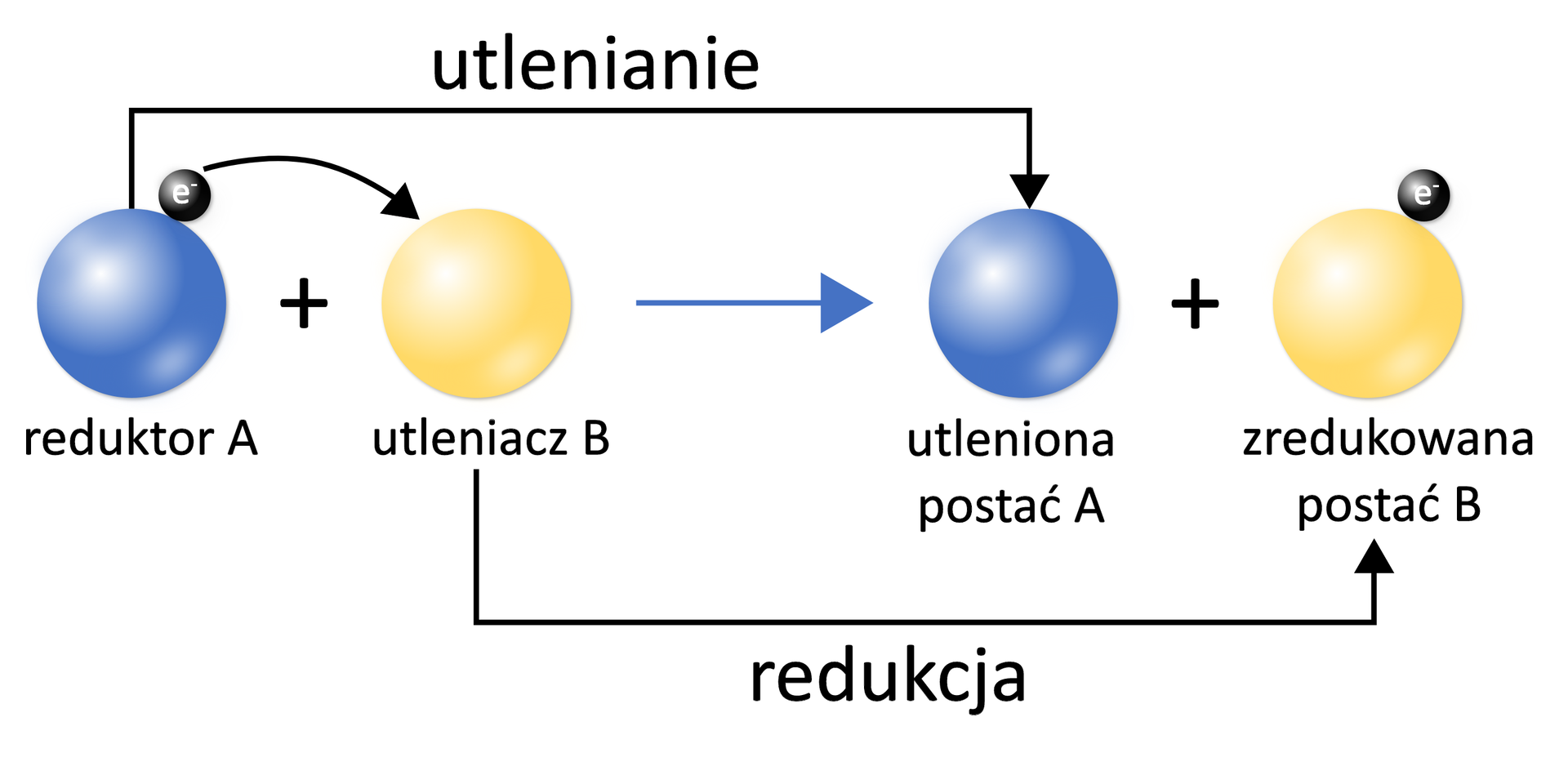
Reakcje utlenienia‑redukcji, inaczej nazywane reakcjami redoks, są to reakcje, w których dochodzi do zmian stopni utlenienia atomów części pierwiastków chemicznych biorących udział w reakcji. W reakcjach chemicznych tego typu równolegle zachodzą dwa procesy:
utlenianieutlenianie – w wyniku tego procesu zwiększa się stopień utlenienia atomu. Stopień utlenienia zwiększa się na skutek oddawania elektronów.
redukcjaredukcja – w wyniku tego procesu zmniejsza się stopień utlenienia atomu. Stopień utlenienia zmniejsza się na skutek przyjmowania elektronów.
Indywiduum, w którym atom pierwiastka zmniejsza stopień utlenienia pełni funkcję utleniacza. Indywiduum, w którym atom pierwiastka zwiększa stopień utlenienia pełni funkcję reduktora.
Reakcje metali z kwasami jako reakcje redoks
W reakcjach metali z kwasami, w zależności od użytego do reakcji chemicznej kwasu, otrzymujemy różne produkty:
Kwasy o słabych właściwościach utleniających
Do kwasów o słabych właściwościach utleniających należą m.in.: kwas solny (chlorowodorowy) , kwas bromowodorowy , kwas fosforowy() , rozcieńczony kwas siarkowy()
W przypadku kwasów o słabych właściwościach utleniających, w wyniku reakcji chemicznej metalu i kwasu, otrzymuje się sól i wodór.
Jednakże reakcja ta zachodzi tylko wtedy gdy metal jest bardziej aktywny od wodoru. Aktywność chemiczną metali prezentuje tzw. szereg aktywności metali:
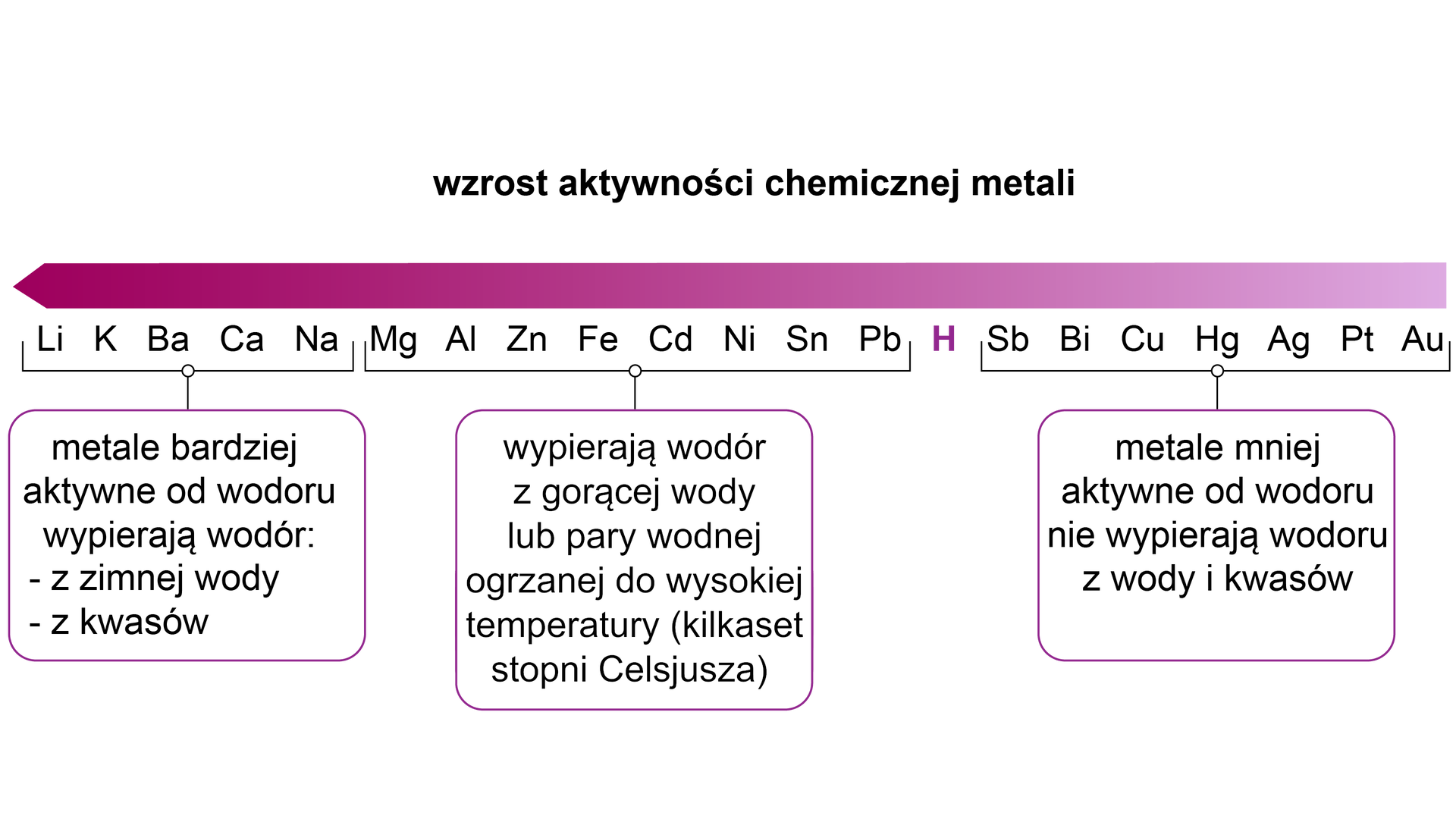
Metale bardziej aktywne od wodoru wypierają go z kwasu. Rozpatrzmy to na przykładzie:
Zapisz równanie reakcji zachodzącej pomiędzy glinem i kwasem solnym (chlorowodorowym). Określ utleniacz i reduktor. Zapisz równania procesów utleniania i redukcji. Zastosuj bilans elektronowy.
1. Zapisanie schematu równania reakcji chemicznej i określenie stopni utlenienia.
Możemy zauważyć, że glin zwiększa swój stopień utlenienia z na – utlenia się, natomiast wodór zmniejsza swój stopień utlenienia z na – redukuje się.
utleniacz: kwas solny (chlorowodorowy)
reduktor: glin
() Równanie procesu utleniania:
Atomy pierwiastków w stanie wolnym występują na zerowym stopniu utlenienia. Glin zwiększa swój stopień utlenienia. Aby ładunki po stronie substratów ( dla obojętnego atomu glinu) i produktów ( dla atomu glinu na stopniu utlenienia) się zgadzały należy dodać elektrony po stronie produktów.
() Równanie procesu redukcji:
Wodór zmniejsza swój stopień utlenienia. Aby ładunki po stronie substratów (, gdyż dwa atomy wodoru występują na stopniu utlenienia) i produktów (, gdyż obydwa atomy wodoru występują na stopniu utlenienia) się zgadzały należy dodać elektrony po stronie substratów.
Liczba elektronów wymienionych w czasie procesów utleniania i redukcji musi być taka sama. Najniższym wspólnym mnożnikiem liczb i jest . Dlatego równanie procesu () mnożymy razy , a równanie procesu () mnożymy razy :
Teraz możemy dobrać współczynniki stechiometryczne:
Na fioletowo zaznaczono utlenienie, a na zielono redukcję.
Kwasy o silnych właściwościach utleniających
Do kwasów o silnych właściwościach utleniających należą: kwas azotowy() stężony i rozcieńczony (), stężony kwas siarkowy() (). Reagują one z metalami aktywniejszymi od wodoru, jak i z metalami szlachetnymi (mniej aktywnymi od wodoru).
Głównym produktem reakcji chemicznej pomiędzy metalem a kwasem o silnych właściwościach utleniających jest sól. Oprócz soli otrzymuje się mieszaninę produktów, której skład jest zależny od stężenia kwasu. W przypadku kwasu azotowego() otrzymuje się tlenek azotu(), tlenek azotu(), azot lub sole amonowe(), np.:
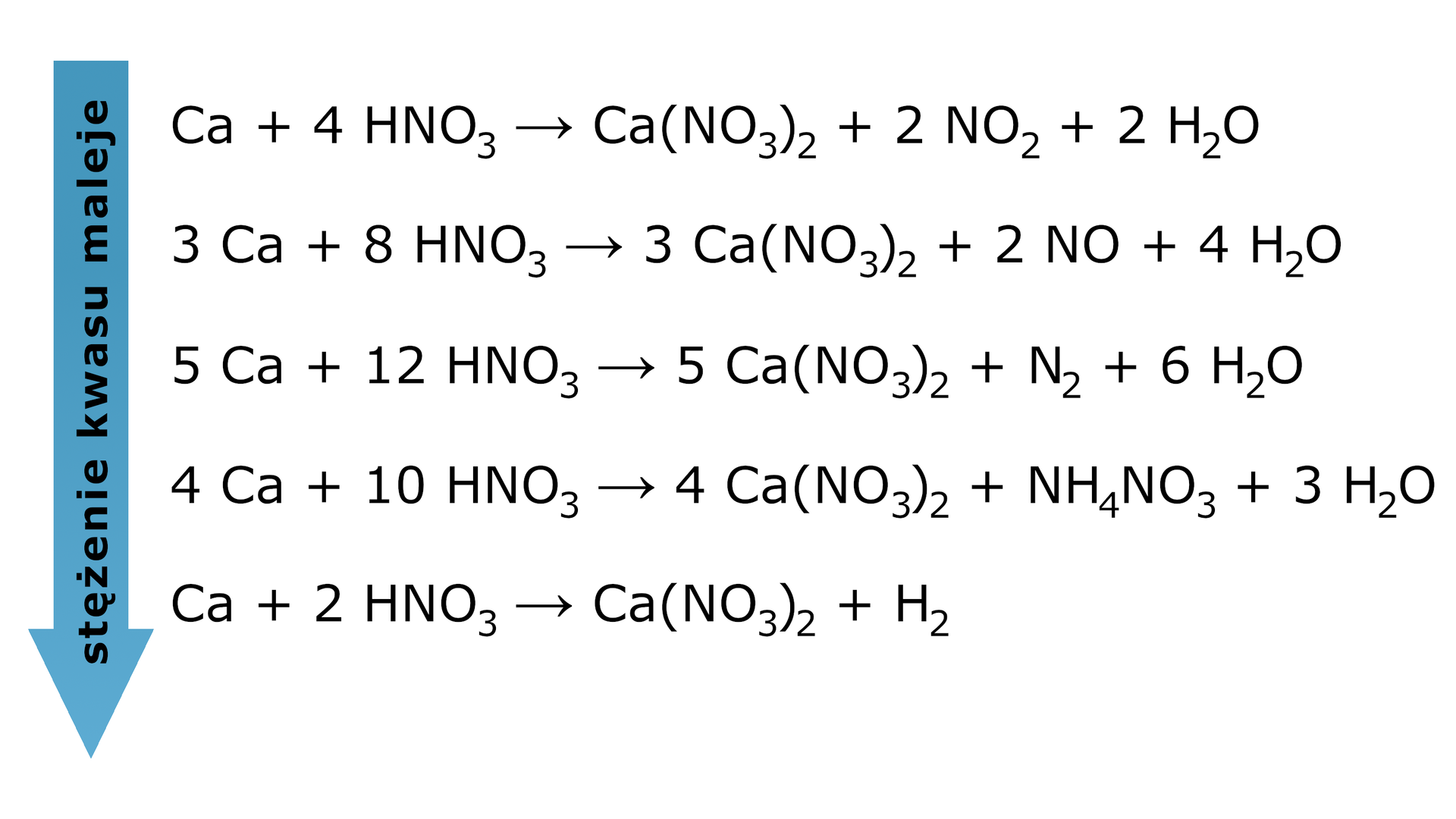
W reakcjach kwasów o właściwościach silnie utleniających z metalami aktywnymi, jeżeli użyjemy bardzo rozcieńczonego kwasu, oprócz soli otrzymuje się wodór. Trudno jednak stwierdzić, czy wydzielający się wodór pochodzi od kwasu, czy z wody.
Rozpatrzmy to na przykładzie równania reakcji metalu z kwasem o silnych właściwościach utleniających:
Zapisz równanie reakcji miedzi ze stężonym kwasem siarkowym(). Określ utleniacz i reduktor. Zapisz równania procesów utlenienia i redukcji. Zastosuj bilans elektronowy.
1. Zapisanie schematu równania reakcji i ustalenie stopni utlenienia
Możemy zauważyć, że miedź zwiększyła swój stopień utlenienia z na – utlenia się, siarka natomiast zmniejszyła swój stopień utlenienia z na – redukuje się.
utleniacz: kwas siarkowy()
reduktor: miedź
2. Zapisanie równania procesów utleniania i redukcji
() Równanie procesu utleniania:
Pierwiastki w stanie wolnym występują na zerowym stopniu utlenienia. Miedź zwiększa swój stopień utlenienia. Aby ładunki po stronie substratów ( dla obojętnego atomu miedzi) i produktów ( dla atomu miedzi na stopniu utlenienia) się zgadzały należy dodać elektrony po stronie produktów.
() Równanie procesu redukcji:
Siarka zmniejsza swój stopień utlenienia. Aby ładunki po stronie substratów ( dla atomu siarki na stopniu utlenienia) i produktów ( dla atomu siarki na stopniu utlenienia) się zgadzały należy dodać elektrony po stronie substratów.
Liczba elektronów w procesach utleniania i redukcji musi być taka sama. W tym przypadku liczba elektronów w obu równaniach () i () jest taka sama. Dlatego też możemy dobierać współczynniki stechiometryczne w równaniu reakcji bez przemnażania równań procesów połówkowych:
Kolorem fiolotowym zaznaczono utlenianie, a kolorem zielonym redukcję.
Podsumowanie
Reakcje metali z kwasami są reakcjami typu redoks. Kwasy pełnią w nich funkcję utleniacza, a metal reduktora.
Słownik
formalna wartość ładunku atomu w danym indywiduum chemicznym przy założeniu, że wszystkie wiązania chemiczne w danym indywiduum mają charakter wiązań jonowych
proces przyjmowania elektronów, związany z obniżaniem stopnia utlenienia
kwasy posiadające wyjątkowo silne właściwości utleniające – mogą zwiększać stopień utlenienia reagującego z nimi indywiduum chemicznego obniżając jednocześnie stopień utlenienia swojego atomu centralnego
proces oddawania elektronów, związany z podwyższaniem stopnia utlenienia reduktora
Bibliografia
Atkins P., Jones L., Podstawy chemii fizycznej, Warszawa 2009.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2007.
Pajdowski L., Chemia ogólna, Warszawa 2002.