Symulacja interaktywna
Aby dobrać współczynniki stechiometryczne dla równania reakcji metalu z kwasem często wykorzystuje się metodę bilansu elektronowego. Wykonaj poniższą symulację, sprawdź jak odpowiednio dobrać dla przykładowych równań reakcji chemicznych współczynniki stechiometryczne, a następnie rozwiąż ćwiczenia sprawdzające.
Aby dobrać współczynniki stechiometryczne dla równania reakcji metalu z kwasem często wykorzystuje się metodę bilansu elektronowego. Zapoznaj się z poniższym opisem symulacji, sprawdź jak odpowiednio dobrać dla przykładowych równań reakcji chemicznych współczynniki stechiometryczne, a następnie rozwiąż ćwiczenia sprawdzające.
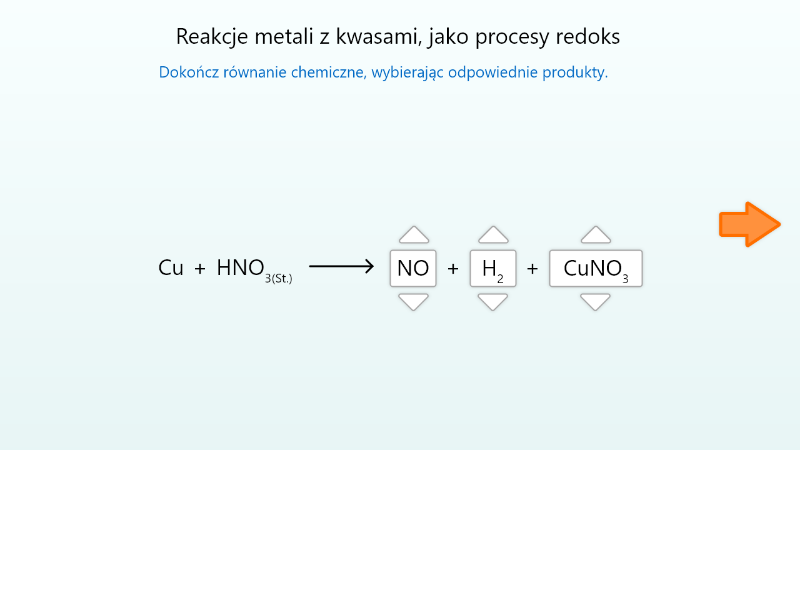
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DFDobidWl
Uzupełnij bilans elektronowy oraz równanie reakcji rozcieńczonego kwasu azotowego() z sodem.
luka do uzupełnienia luka do uzupełnienia
luka do uzupełnienia luka do uzupełnienia luka do uzupełnienia