Przeczytaj
Rozpad na jony
Pamiętasz, że woda jest dipolemdipolem, dlatego posiada zdolność do oddziaływania na substancje o wiązaniach jonowych, co z kolei powoduje ich rozpad na jony. Proces ten nazwany został przez Arrheniusa (czyt. arenjusa) dysocjacją elektrolitycznądysocjacją elektrolityczną (lub dysocjacją jonową), a związki, które ulegają temu procesowi, są nazywane elektrolitami. Elektrolity, rozpuszczając się w wodzie, dysocjują na jony, a tak powstałe roztwory przewodzą prąd elektryczny. Elektrolity również po stopieniu stają się cieczami zdolnymi do przewodzenia prądu. Przyjęto, że w równaniach dysocjacji jonowej mocnych elektrolitówmocnych elektrolitów strzałkę piszemy w jedną stronę. Natomiast w przypadku słabych elektrolitówsłabych elektrolitów zapisujemy dwie strzałki, skierowane w przeciwne strony.
Substancje o wiązaniach jonowych można podzielić na kilka grup, w zależności od budowy chemicznej.
- Nazwa kategorii: związki o budowie jonowej
- Nazwa kategorii: sole jonowe
- Nazwa kategorii: wodorotlenki
- Nazwa kategorii: tlenki metali
- Nazwa kategorii: wodorki (litowców[br]i berylowców[br]z wyjątkiem[br]berylu i magnezu)
- Nazwa kategorii: azotki[br](litowców i berylowców)
- Nazwa kategorii: węgliki metali[br]grup 1, 2 oraz 13
- Nazwa kategorii: nadtlenki [br]i ponadtlenki [br] niektórych metali[br] (np. potasu) Koniec elementów należących do kategorii związki o budowie jonowej
- Elementy należące do kategorii związki o budowie jonowej
Czy wszystkie spośród wymienionych związków dysocjują w wodzie?
Co istotne, wśród wymienionych grup związków, dysocjacji elektrolitycznej ulegają jedynie sole jonowe i wodorotlenki rozpuszczalne w wodzie. Pozostałe związki nie dysocjują w wodzie, a z nią reagują.
Przykładem są wodorki metali pierwszej i drugiej grupy układu okresowego, które reagują z wodą gwałtownie z wydzieleniem wodoru.
Azotki litowców i berylowców reagują z wodą z wydzieleniem amoniaku, np:
Z kolei węgliki metali grup pierwszej, drugiej oraz grupy trzynastej, tworzą z wodą związki organiczne. Przykładem jest reakcja węgliku wapnia z wodą, w wyniku której powstaje, oprócz wodorotlenku wapnia, także etyn (acetylen).
Dysocjacja związków jonowych zachodzi, gdy cząsteczki wody „rozbijają” kryształ jonowy. Dzieje się tak ze względu na silne przyciąganie między odpowiednimi biegunami cząsteczek wody, a dodatnimi i ujemnymi jonami w krysztale. Następnie cząsteczki wody otaczają kationy i aniony, co określane jest mianem hydratacjihydratacji. Podczas gdy w krysztale jony zajmowały ściśle określone miejsce, w roztworze mogą się swobodnie poruszać, przez co znajdują się w bardziej nieuporządkowanym stanie.
Poniżej opisano sposób dysocjacji elektrolitycznej soli oraz wodorotlenków.
Dysocjacja soli
Sole rozpuszczalne w wodzie dysocjują całkowicie na kation metalu (lub inny, np. kation amonu ) i anion reszty kwasowej. Zaliczane są do mocnych elektrolitówmocnych elektrolitów, a proces ich dysocjacji można zapisać schematycznie:
gdzie:
– kation metalu, kation amonu () lub kation organiczny;
– reszta kwasowa;
– wartościowość reszty kwasowej;
– wartościowość .
Sole prosteSole proste (sole obojętne) dysocjują jednostopniowo (w roztworach nie wykryto pośrednich produktów dysocjacji elektrolitycznej):
Na przykład chlorek potasu () dysocjuje na kationy sodu i aniony chlorkowe. W indeksie dolnym często zapisuje się skrót (aq), który oznacza hydratację jonów.
Sól podczas dysocjacji elektrolitycznej rozpada się na aniony i kationy. W wyniku dysocjacji elektrolitycznej jednego mola chlorku wapnia powstaje jeden mol kationów wapnia i dwa mole anionów chlorkowych.
Bilans ładunków po stronie substratów i produktów:
W chlorku wapnia, na jeden mol kationów wapnia przypadają dwa mole anionów chlorkowych. W takim przypadku, w zapisie równań procesów dysocjacji elektrolitycznej, należy pamiętać o zasadzie zachowania ładunku. Oznacza to, że suma ładunków po stronie substratów musi być równa sumie ładunków po stronie produktów.
Bilans ładunków po stronie substratów:
Po stronie substratów ładunek wynosi .
Bilans ładunków po stronie produktów:
Po stronie produktów mamy jeden mol dwudodatnich kationów wapnia i dwa mole jednoujemnych anionów chlorkowych .
Bilans ładunków po stronie produktów wynosi zatem .
Wśród soli szczególne miejsce zajmują wodorosole oraz hydroksosole, które, w przeciwieństwie do soli prostych, dysocjują wieloetapowo. Przyjrzymy się dysocjacji soli – diwodoroortofosforanu() sodu.
etap dysocjacji wodorosoli:
etap dysocjacji wodorosoli:
etap dysocjacji wodorosoli:
Odszczepienie jonów wodoru od jonu diwodoroortofosforanowego() () i jonu wodoroortofosforanowego() () zachodzi tylko w pewnym stopniu (symbol dwóch strzałek), ponieważ atomy wodoru łączą się z atomami tlenu wiązaniem kowalencyjnym, a nie wiązaniem jonowym.
Dysocjacja wodorotlenków
Wśród elektrolitówelektrolitów możemy wyróżnić także wodorotlenki. Podczas rozpuszczania w wodzie, związki te dysocjują na aniony wodorotlenkowe i kationy metali. Dysocjację elektrolityczną wodorotlenków przedstawia się równaniem:
gdzie:
– symbol metalu;
– wartościowość metalu równa liczbie anionów wodorotlenkowych.
Dysocjacji w wodzie ulegają wodorotlenki metali aktywnych, np. . Dla tego związku dysocjację zapisujemy zgodnie z równaniem:
Podobnie jak w przypadku soli jonowych, powstałe jony są hydratowane przez cząsteczki wody, co przedstawiono na poniższej ilustracji. Całkowita dysocjacja oznacza, że mamy do czynienia z elektrolitem mocnymelektrolitem mocnym.

Niektóre wodorotlenki ulegają dysocjacji elektrolitycznej w kilku etapach. Przykładem jest wodorotlenek wapnia, który dysocjuje dwuetapowo:
Wodorotlenki metali pierwszej i drugiej grupy układu okresowego (z wyjątkiem wodorotlenku berylu) są zaliczane do mocnych elektrolitówmocnych elektrolitów, a ich roztwory wodne nazywane są zasadami. Ulegają one praktycznie całkowitej dysocjacji w wodzie. Oczywiście ich rozpuszczalność w wodzie jest różna, np. wodorotlenek magnezu i wodorotlenek wapnia rozpuszczają się w wodzie słabo, niemniej całość rozpuszczonego ciała stałego ulega dysocjacji na jony. Chociaż wszystkie te wodorotlenki zaliczamy do mocnych, to również w tej grupie możemy wyznaczyć pewne tendencje. Najmocniejsze są bowiem te wodorotlenki, które są zbudowane z jonów metali o najmniejszej elektroujemności. Moc wodorotlenków metali pierwszej i drugiej grupy układu okresowego zmienia się zgodnie ze schematem:

Co ważne, o mocy wodorotlenku decyduje różnica elektroujemności pomiędzy metalem a tlenem. Im ta różnica jest większa, tym słabsze wiązanie występuje pomiędzy anionem a kationem metalu. Im słabsze wiązanie, tym łatwiejszy rozpad na jony. Zatem dysocjacja elektrolityczna zachodzi w większym stopniu.
Podsumowując, wodorotlenki metali i grupy to mocne wodorotlenki, dlatego w zapisie ich dysocjacji stosujemy zawsze strzałkę w jedną stronę. Najmocniejszym z tych wodorotlenków, jak możesz wywnioskować ze schematu, jest wodorotlenek cezu.
Z uwagi na dużo mniejszą różnicę elektroujemności pomiędzy metalem a tlenem dla wodorotlenków metali grup od do , wodorotlenki te zaliczamy do słabych wodorotlenków. Co ważne, większość z nich jest również słabo rozpuszczalna w wodzie. Wszystko to sprawia, że wodorotlenki te są słabymi elektrolitamisłabymi elektrolitami. Przykładem słabego elektrolitu jest np. wodorotlenek żelaza().
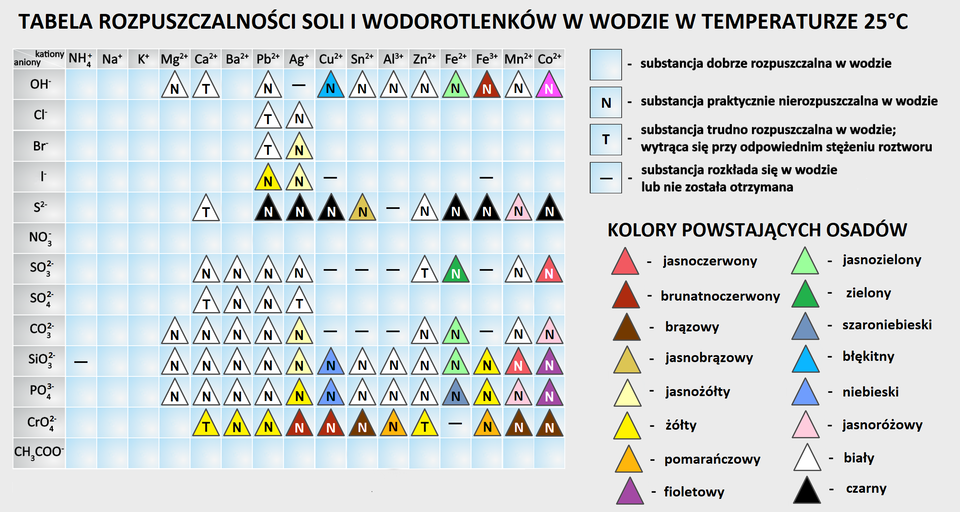
Rozpuszczalność wodorotlenków i soli można odczytać z tablicy rozpuszczalności, w której znajdują się dane obrazujące charakter rozpuszczalności powstającego związku (osadu) w wodzie. Jeśli powstająca substancja jest:
(R) rozpuszczalna – jej rozpuszczalność w wodzie jest większa niż gram na gramów wody, co jest równoznaczne z tym, że substancja ta występuje w roztworze w postaci jonów;
(T) trudno rozpuszczalna – strąca się w postaci osadu przy odpowiednim stężeniu roztworów (zazwyczaj z roztworów stężonych); jej rozpuszczalność w wodzie mieści się w granicach od do grama na gramów wody;
(N) nierozpuszczalna – strąca się w postaci osadu z roztworów rozcieńczonych; jej rozpuszczalność w wodzie leży powyżej grama na gramów wody.
Indeks dolny Źródło: wikipedia.org, data dostępu: 16.03.2020 r. Indeks dolny koniecŹródło: wikipedia.org, data dostępu: 16.03.2020 r.
Rozpuszczanie związku jonowego jest ułatwione przez przyciąganie między jonami związku a cząsteczkami wody.
Gdy substancje jonowe dysocjują całkowicie lub prawie całkowicie, mówimy, że są mocnymi elektrolitamimocnymi elektrolitami. Podczas niecałkowitej dysocjacji mamy do czynienia ze słabymi elektrolitamisłabymi elektrolitami.
Im więcej jonów w roztworze po rozpuszczeniu substancji, tym silniejszy elektrolit.
Sole i wodorotlenki, które są rozpuszczalne w wodzie, w roztworze występują w postaci jonów.
Podczas pisania równań dysocjacji elektrolitycznej związków jonowych należy pamiętać o zasadzie zachowania ładunku.
Słownik
(łac. dissociatio „rozdzielenie”) samorzutny proces rozpadu związków chemicznych będących elektrolitami (kwasów, wodorotlenków, soli) w roztworach, na dodatnio i ujemnie naładowane cząstki, tj. jony pod wpływem działania rozpuszczalnika
cząsteczka polarna, w której można wyróżnić biegun ujemny i biegun dodatni
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) związek chemiczny, który ulega procesowi rozpadu na jony pod wpływem wody i jest zdolny do przewodzenia prądu elektrycznego; gdy jest całkowicie zdysocjowany, mówimy o elektrolicie mocnym
inaczej: uwodnienie – proces, podczas którego, na skutek oddziaływań międzycząsteczkowych lub w wyniku tworzenia wiązań chemicznych, cząsteczki wody otaczają i przyłączają się do cząsteczek innych substancji lub jonów
substancja, która całkowicie dysocjuje po rozpuszczeniu w wodzie
substancja, która dysocjuje tylko częściowo po rozpuszczeniu w wodzie
zawierają jeden rodzaj kationu i jeden rodzaj anionu
Bibliografia
Douglas W., Skoog A., West D. M., Holler J. F., Crouch S. R., Podstawy chemii analitycznej, Warszawa 2006, t. 1, s. 232.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Staluszka J., Chemia 3. Równowagi i procesy jonowe, Gdynia 2006.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.

