Przeczytaj
Twardość wody
Twardość wody związana jest z występowaniem w wodzie jonów pochodzących z dysocjacji rozpuszczalnych w wodzie soli. W przeważającej ilości są to sole wapnia i magnezu. Powoduje ona m.in. zatykanie rur, większe zużycie detergentów oraz powstawianie kamienia kotłowego. Wyróżnia się dwa główne rodzaje twardości wody.

Twardość węglanowa (przemijająca)
Twardość węglanową nadają wodzie rozpuszczone w niej wodorowęglany wapnia i magnezu . Twardość przemijająca jest przyczyną powstawania osadów węglanu wapnia i magnezu – tzw. kamienia, obserwowanego np. w czajnikach czy też piecach grzewczych, co może prowadzić do awarii tych urządzeń.
Twardość niewęglanowa (trwała)
Twardość niewęglanowa, inaczej nazywana trwałą, związana jest z obecnością głównie siarczanów, chlorków, azotanów wapnia i magnezu. Ze względu na negatywny efekt twardej wody na nasz komfort życia, wynaleziono metody zmiękczania wody.
Metody zmiękczania wody
Zmiękczanie wody polega na usunięciu z wody rozpuszczalnych soli, generujących twardość wody. Są to w przeważającej mierze sole wapnia i magnezu. Twardą wodę można zmiękczyć na kilka sposobów.
Metoda termiczna
Metoda ta polega na ogrzewaniu twardej wody. Pod wpływem temperatury wodorowęglany wapnia i magnezu ulegają przemianie i opadają na dno naczynia w postaci związków trudno rozpuszczalnych w wodzie. Stąd właśnie bierze się osad w czajniku. Za pomocą tej metody usuwa się jedynie twardość węglanową (przemijającą).
Wodorowęglan magnezu częściowo przekształca się również w wodorotlenek magnezu:
Wynika z tego, że kamień kotłowy składa się z węglanu wapnia i magnezu oraz wodorotlenku magnezu .
Metoda sodowo‑wapienna
Metoda ta polega na dodaniu do wody jonów wapnia w postaci wapna gaszonego i węglanu sodu . Wapno gaszone usuwa twardość przemijającą wody:
Węglan sodu usuwa twardość trwałą wody:
W przypadku tej metody, powstałe osady powoli opadają na dno zbiornika lub są z niego odfiltrowywane.
Metoda fosforanowa
W reakcji z wodą fosforan() sodu tworzy nierozpuszczalne fosforany w połączeniu z jonami wapnia i magnezu.
Fosforany znajdują zastosowanie w proszkach do prania jako środki zmiękczające wodę.
Metoda jonitowa
Metoda ta polega na zastosowaniu jonitów (wymieniaczy jonowych). Jonity to substancje wielocząsteczkowe (R), nierozpuszczalne w wodzie. Występują w postaci żelu lub substancji porowatej. Posiadają zdolność selektywnej wymiany własnych jonów na te, które znajdują się w otaczającym je roztworze. Na swojej powierzchni posiadają grupy funkcyjne wiążące jony. Jonity, które wymieniają kationy, to kationity, posiadające na swojej powierzchni grupy o właściwościach kwasowych, np. , , , . Kationity wymieniają jony wodoru na zawarte w wodzie kationy metali. W uproszczeniu ilustruje to poniższy schemat:

Po przepuszczeniu twardej wody przez kationit, następuje zatrzymanie kationów metali zawartych w wodzie na powierzchni kationitu oraz uwolnienie jonów wodoru pochodzących z kationitu. Jony te z cząsteczkami wody tworzą następnie jony oksoniowe . Pojawienie się w wodzie nadmiaru tych jonów skutkuje jej zakwaszeniem.
Następnie woda, po przejściu przez kationit, zostaje przepuszczona przez anionit. AnionitAnionit to jonit, który wymienia aniony. Na swojej powierzchni posiada grupy funkcyjne o właściwościach zasadowych. Aniony występujące w wodzie zostają zatrzymane na powierzchni anionitu, a jony wodorotlenkowe zostają uwolnione z anionitu. W uproszczeniu ilustruje to poniższy schemat:
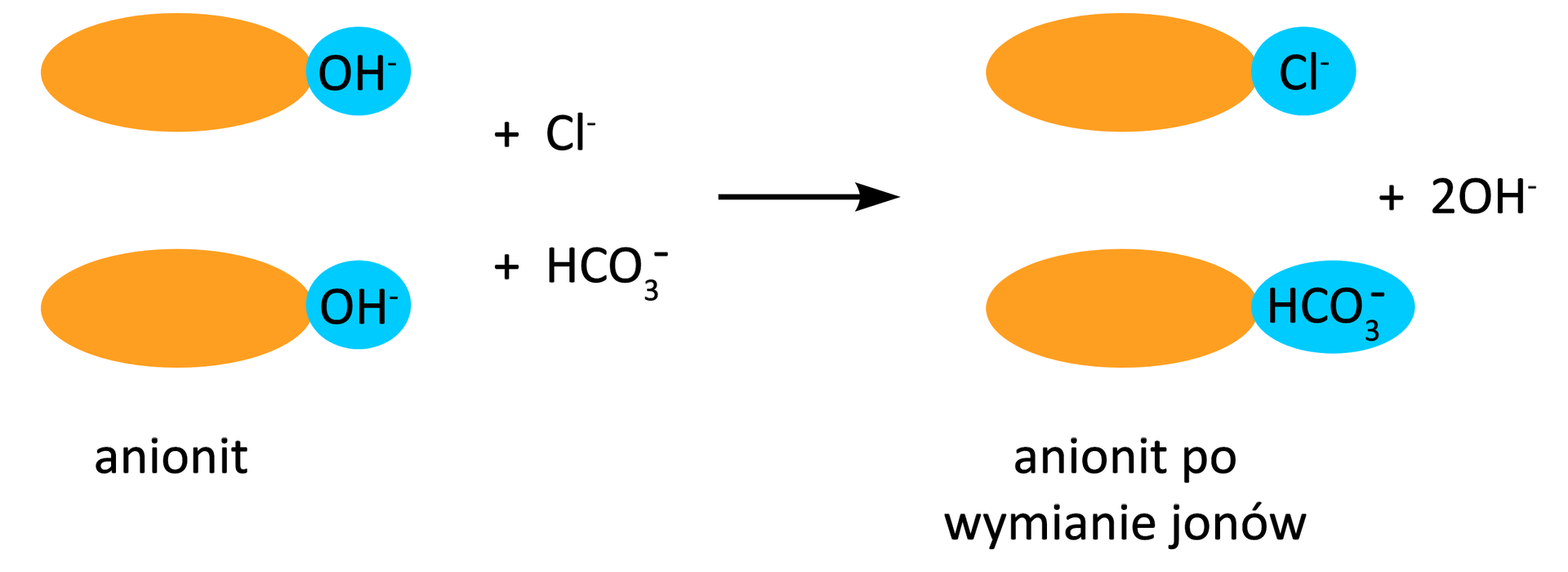
Jony wodorotlenkowe reagują z jonami uwolnionymi po przejściu przez kationit, dzięki czemu dochodzi do neutralizacji wody (wtedy ma odczyn obojętny).
W celu dalszego używania jonitów należy je zregenerować – czyli uzupełnić jony, które zostały wypłukane. Kationity regeneruje się, przepuszczając przez jonit roztwór kwasu chlorowodorowego , a anionity – poprzez przepuszczenie roztworu wodorotlenku sodu .
Powyższe substancje używane do regeneracji są niebezpieczne w użytku codziennym, ponieważ wylane przez przypadek na skórę mogą powodować poparzenia. Ponadto do zmiękczenia wody potrzeba zarówno kationitu, jak i anionitu, co zwiększa rozmiary urządzenia, które mogłoby być zastosowane do zmiękczenia wody w domu. Problem ten został rozwiązany przez zastosowanie zmiękczaczy wody opartych na kationitach, które zamiast jonów wodoru zawierają jony sodu. Twarda woda zostaje przepuszczona przez kationit, a wówczas dochodzi do wymiany kationów sodu na kationy wapnia i magnezu.
Do regeneracji takiego kationitu wykorzystuje się solankę – roztwór chlorku sodu . W wyniku regeneracji kationit odzyskuje jony sodu , a w roztworze, po przejściu przez kationit, znajdują się jony , oraz , które trafiają do kanalizacji.
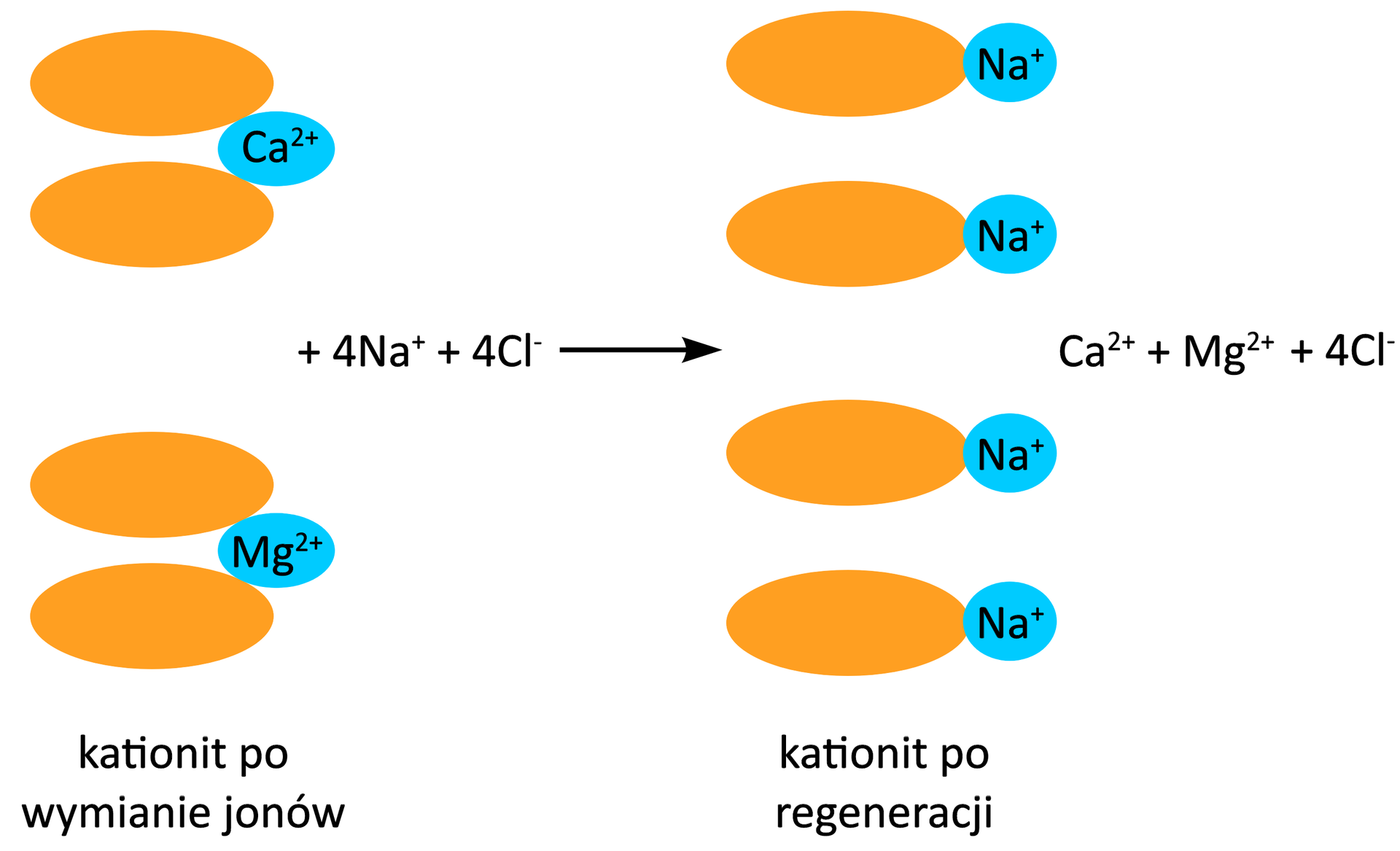
Zmiękczacze wody, zawierające w swojej budowie kationit z jonami sodu, instaluje się w piwnicy przy wlocie zimnej wody. Dzięki temu zmiękcza się wodę na terenie całego mieszkania. Wadą tego rozwiązania jest to, że trzeba pamiętać o uzupełnianiu roztworu chlorku sodu, który jest stosowany do regeneracji jonitu.

Obecnie częstym rozwiązaniem do zmiękczania wody pitnej są dzbanki filtracyjne bądź także filtry zakładane bezpośrednio na kran. Urządzenia te wykorzystują węgiel aktywnywęgiel aktywny oraz jonity. Ich wadą jest częsta konieczność wymiany filtrów oraz zbyt krótki okres przepływu wody przez filtry. Powoduje to, że woda może nadal zawierać jony wapnia i magnezu.
Słownik
inaczej wymieniacze jonowe; substancje wielocząsteczkowe, nierozpuszczalne w wodzie; występują w postaci żelu lub substancji porowatej; posiadają zdolność selektywnej wymiany własnych jonów na te, które znajdują się w otaczającym je roztworze
substancje wymieniające własne aniony na aniony z otaczającego je roztworu
substancje wymieniające własne kationy na kationy z otaczającego je roztworu
wodorotlenek wapnia
substancja składająca się z pierwiastkowego węgla o dużej powierzchni, zdolna do wiązania związków chemicznych
węglan sodu
Bibliografia
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura chemia vademecum, Warszawa 2018.
Jones L., Atkins P., Chemia ogólna Cząsteczki, materia, reakcje, Warszawa 2012.
Klimaszewska M., Chemia od A do Z Repetytorium matura egzaminy na wyższe studia, Warszawa 1996.