Przeczytaj
Czym jest roztwór koloidalny?
Roztwór koloidalnyRoztwór koloidalny jest przykładem układu dyspersyjnegodyspersyjnego, w którym średnica cząsteczek fazy rozproszonej mieści się w przedziale: 1 nmnm < d < 100 nm (10Indeks górny –9–9–10Indeks górny –7–7 m).
Przykładami takich roztwór są:
mleko,
mleczka do demakijażu,
lakier do paznokci,
mgła,
dym,
styropian.
Jakie są cechy układu koloidalnego?
Układ koloidalny jest układem heterogenicznym (niejednorodnym). Oznacza to, że jego składniki można rozróżnić gołym okiem lub za pomocą przyrządów optycznych.
Cząstki fazy rozproszonej w ośrodku ciekłym lub gazowym poruszają się ruchami Browna. Są to nieustanne, chaotyczne ruchy postępowe, obrotowe i drgające. Cząstki te mają zdolność do rozpraszania światła z wytworzeniem charakterystycznego stożka świetlnego, nazywanego efektem Tyndallaefektem Tyndalla.

Podlegają one zjawisku elektrokinetycznemu, jakim jest elektroforezaelektroforeza. Pod wpływem pola elektrycznego, naładowane cząstki roztworów koloidowych poruszają się w nieruchomym ośrodku rozpraszającym. Jeżeli cząstki poruszają się ku anodzie – jest to anaforeza, jeżeli ku katodzie – kataforeza.
Ich charakterystyczną cechą jest także zdolność do koagulacji, czyli łączenia się w większe zespoły, w wyniku czego tworzy się żel.
Klasyfikacja koloidów
Ze względu na powinowactwo do fazy rozpraszającej (woda), układy koloidalne możemy podzielić na roztwory koloidalne hydrofilowe i hydrofobowe.
Do koloidów hydrofilowych zaliczane są koloidy molekularne (białka, kwasy nukleinowe, polisacharydy) oraz roztwory micelarne (mydła, detergenty), które mają wysokie powinowactwo do fazy rozpraszającej. Istnieją również koloidy hydrofobowe o niskim powinowactwie i zaliczamy do nich np. sole srebra.
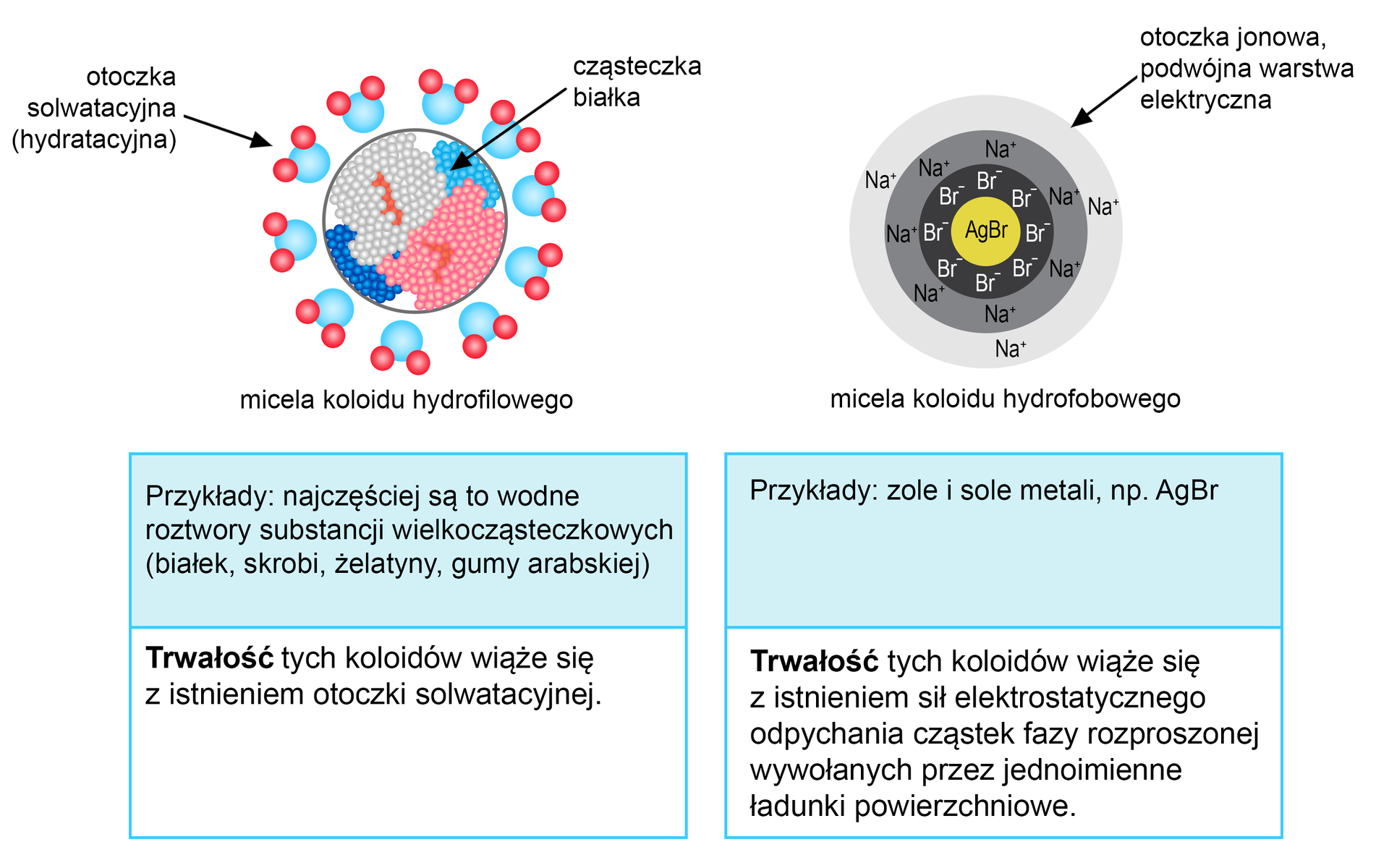
HydrofiloweHydrofilowe cząsteczki koloidalne w roztworze otoczone są przez cząsteczki rozpuszczalnika, które stanowią tzw. otoczkę solwatacyjną. W czasie koagulacji część cząsteczek traci swoją otoczkę utworzoną z wody i grupuje się w większe agregaty. Jest to proces zwany koagulacją.

Słownik
(gr. kólla „klej”, eídos „postać”) układ koloidalny, układ koloidowy; układ dyspersyjny (rozproszony), tj. składający się z fazy rozpraszającej (zwanej fazą ciągłą lub ośrodkiem dyspersyjnym) i fazy rozproszonej (zwanej fazą zdyspergowaną)
układ rozproszony; układ wielofazowy (zwykle dwufazowy), w którym cząstki jednej z faz (zwanej fazą rozproszoną) są równomiernie rozproszone w drugiej fazie (zwanej fazą rozpraszającą)
(gr. nanos „karzeł”) nano- n; przedrostek jednostki miary oznaczający mnożnik 10Indeks górny –9–9; np. 1 nm = 10Indeks górny –9–9 m
rozpraszanie światła przez drobne cząstki zawiesiny w ośrodkach mętnych (jak np. kurz, mgła w powietrzu) lub zagęszczenia cząsteczek (atomów) czystej substancji, w której, wskutek ruchu cieplnego, zachodzą fluktuacje gęstości
(gr. etalambdaepsilonkappataurhoomicronphiόrhoetasigmaeta „noszenie elektronów”, ang. electrophoresis) jedno ze zjawisk elektrokinetycznych, polegające na poruszaniu się naładowanych cząstek (makrocząsteczek lub cząstek koloidowych w nieruchomym ośrodku rozpraszającym albo jonów w roztworze np. wewnątrz kapilary) pod wpływem pola elektrycznego
(gr. hydro ,”woda”, phobos „strach” ) właściwość substancji, która polega na zdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą bądź grupami polarnymi innych związków; cecha makroskopowa materiałów polegająca na pokrywaniu się makroskopową warstwą wody
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.