Przeczytaj
Procesy samorzutne i niesamorzutne
Proces samorzutny wykazuje dążność do zachodzenia bez konieczności wykonywania pracy nad układem. Analogicznie, proces niesamorzutny nie wykazuje tendencji do zachodzenia, więc można go wymusić przez dostarczania energii do układu.

Proces samorzutny – nie wymaga „akcji” z zewnątrz.
Proces niesamorzutny – wymaga ingerencji z zewnątrz.
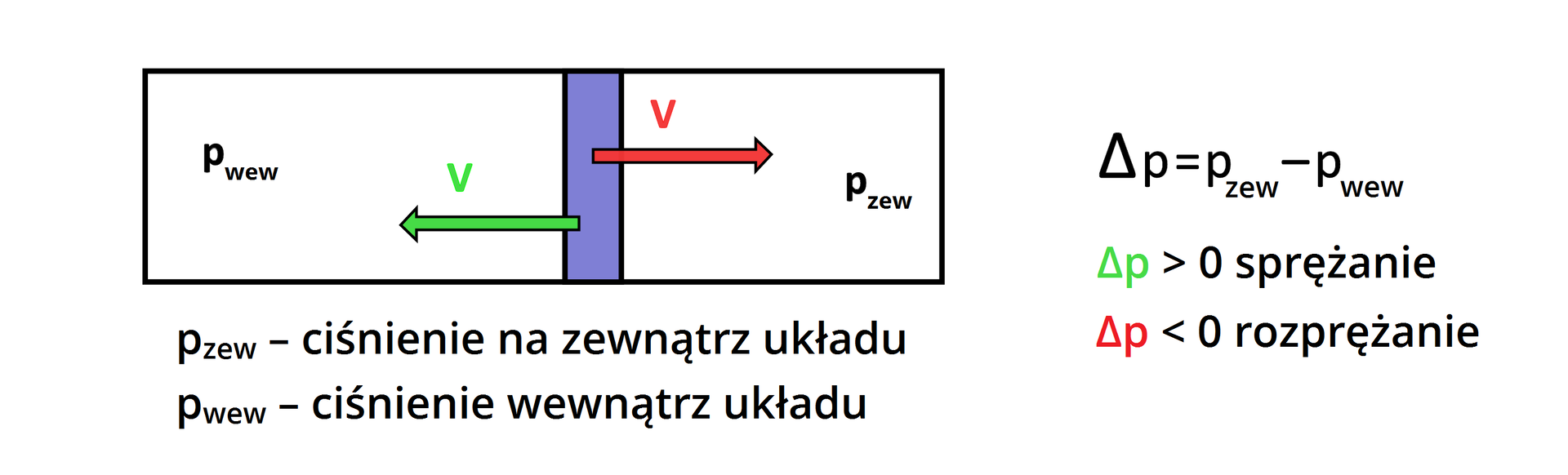
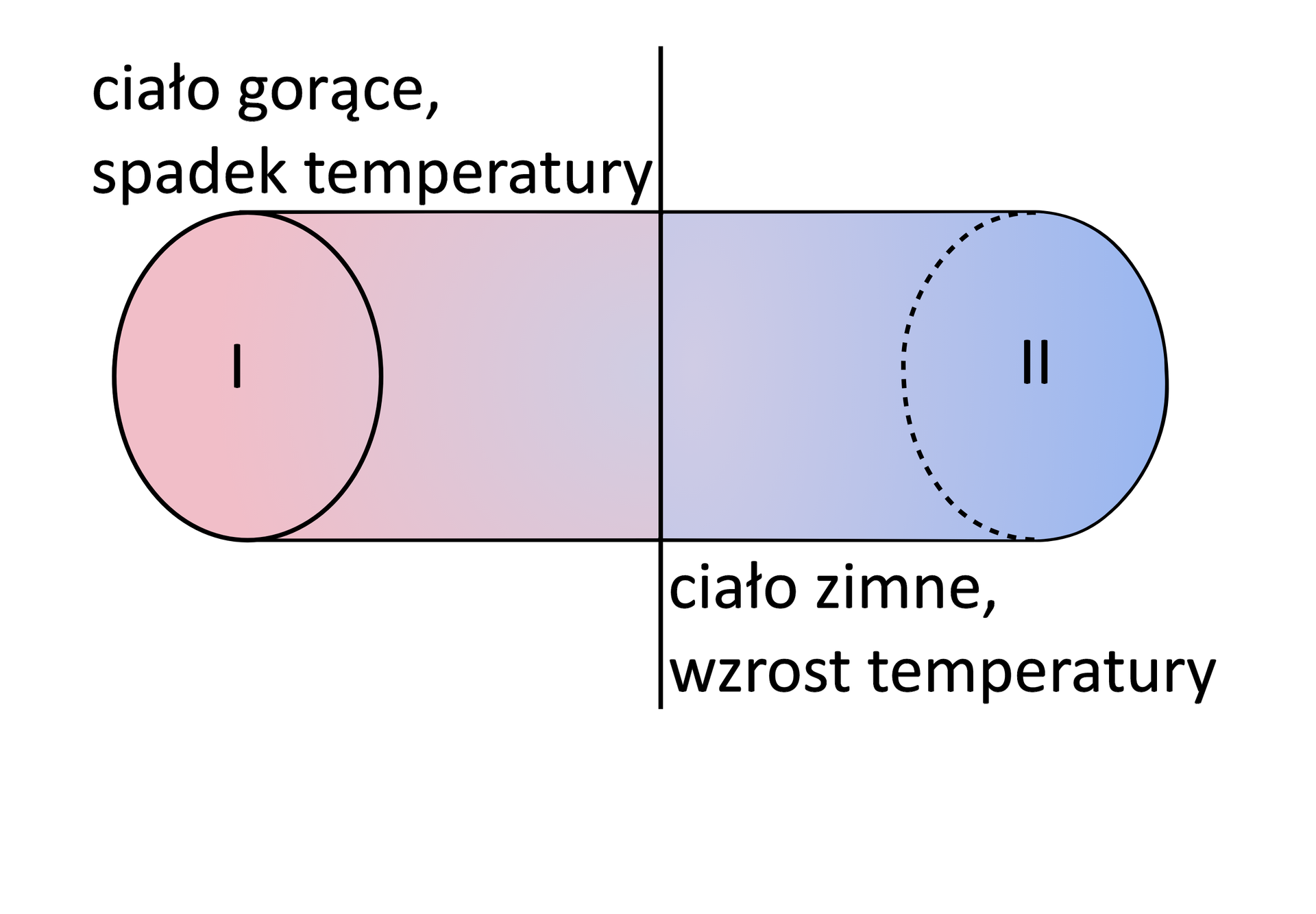
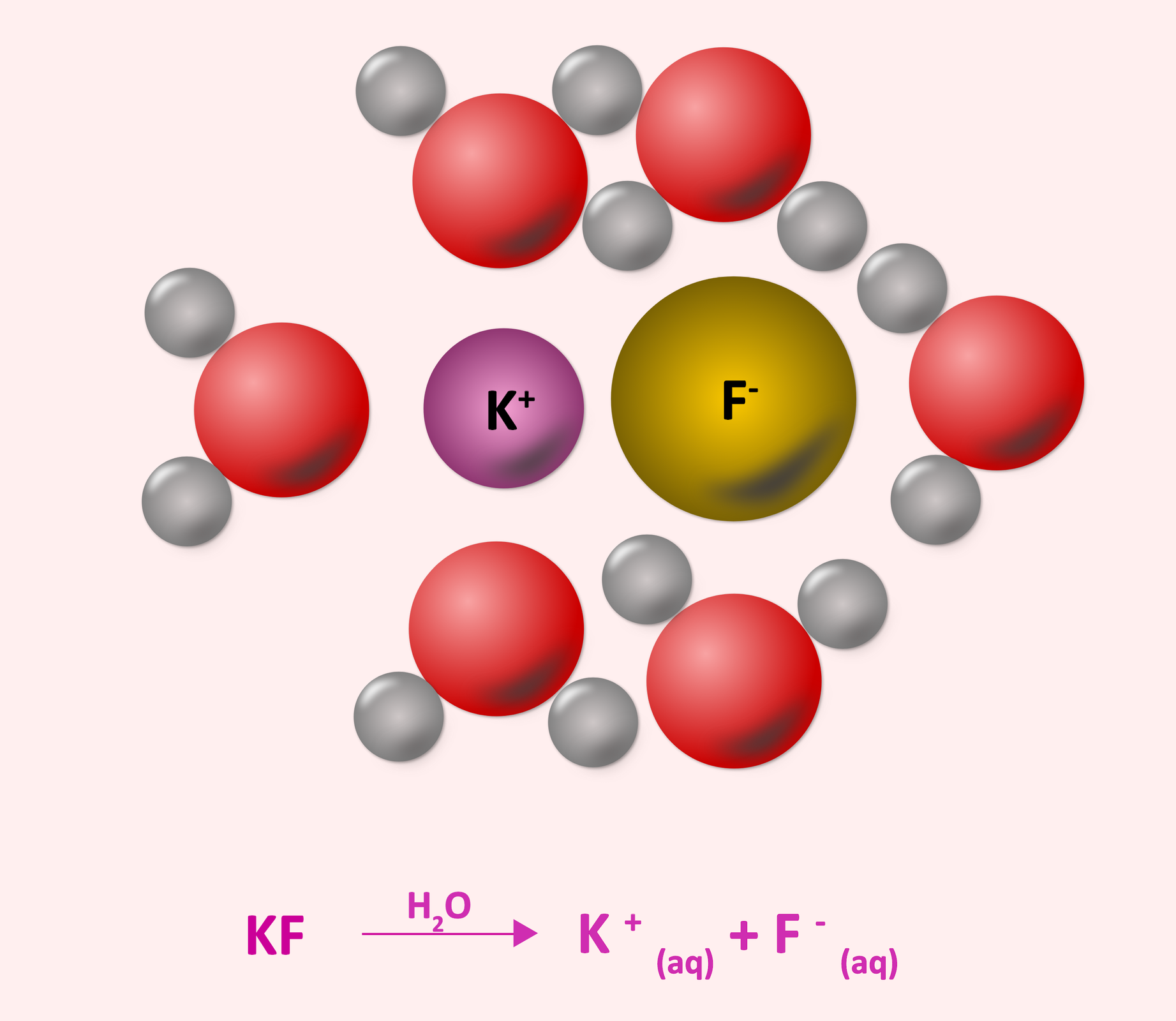
Samorzutnie przebiegają zarówno procesy endoenergetyczne, jak i procesy egzoenergetyczne (np. rozpuszczanie stężonych kwasów w wodzie). Procesy samorzutne mogą zachodzić bez konieczności wykonania pracy na układzie – jak np. rozprężanie gazu do próżni czy przepływ ciepła od ciała gorącego do zimnego. Z kolei aby zaszedł proces niesamorzutny (wymuszony), trzeba do układu dostarczyć energię w postaci wykonanej pracy – np. sprężanie gazu bądź przepływ ciepła z ciała zimnego do ciepłego.
Procesy samorzutne
Procesy niesamorzutne
Entropia
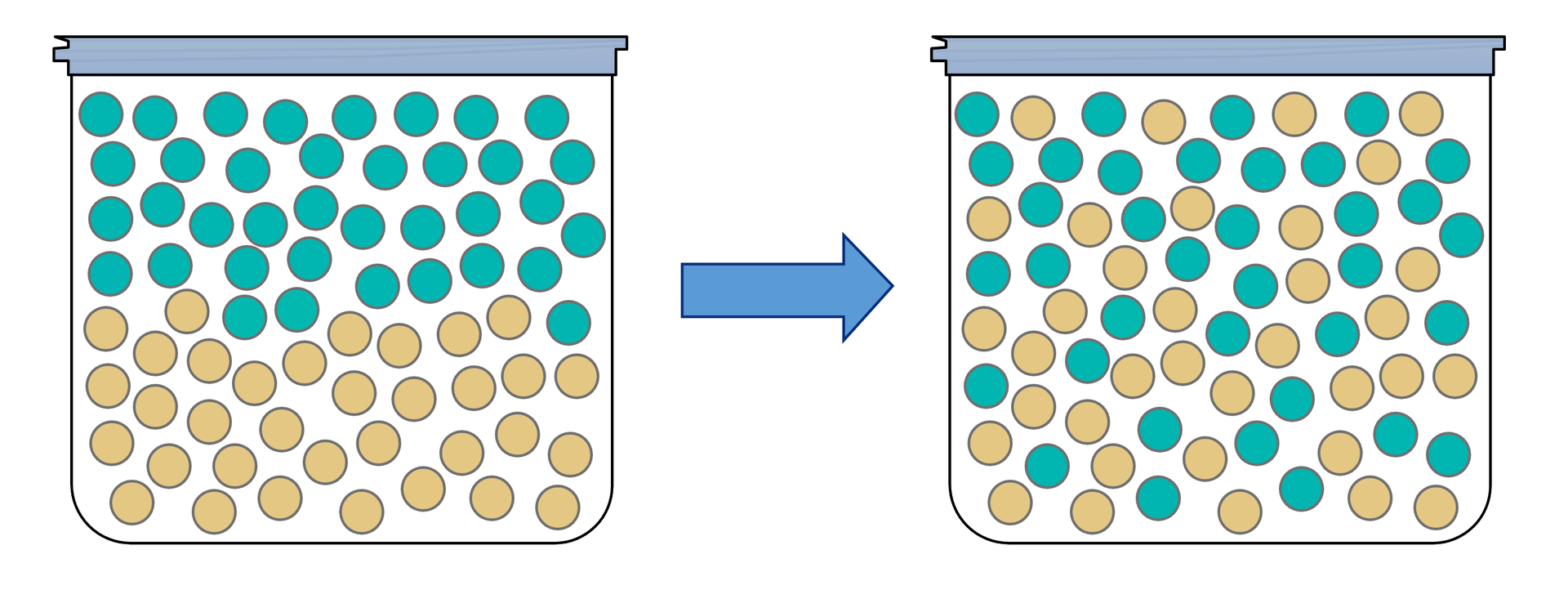
Siłą napędową procesów samorzutnych jest tendencja energii i materii do zwiększania stanu nieuporządkowania. Miarą stopnia nieuporządkowania materii i energii jest funkcja stanu zwana entropiąentropią, oznaczana symbolem S. Wprowadził ją Rudolf Clausius. Pozwala na określenie, czy dany proces będzie samorzutny, czy nie.
Według Clausiusa, zmiana entropii układu zamkniętegoukładu zamkniętego w procesie odwracalnym jest równa ilorazowi zmiany ciepła (), wymienionego przez układ z otoczeniem i temperatury (), w jakiej ta wymiana się dokonuje.
Jeżeli układ zamknięty zmienia swój stan w wyniku nieodwracalnego procesu samorzutnego, to zmiana entropii układu jest większa od wartości ilorazu ciepła, wymienionego przez układ z otoczeniem i temperatury:
W przypadku układów nieizolowanych, możliwe jest zachodzenie procesu samorzutnie, dla którego entropia układu jest ujemna – jak np. procesy skraplania lub krzepnięcia. Jest to możliwe z uwagi na wydzielaną w trakcie tych procesów energię do otoczenia. Powoduje ona wzrost entropii otoczenia i jest większa niż spadek entropii układu. Można więc powiedzieć, że w układzie nieizolowanym reakcja zachodzi samorzutnie wtedy, gdy suma zmian entropii układu i entropii otoczenia jest większa od zera.
Wnioski
W wielu przypadkach trudno jest przewidzieć, czy stan nieuporządkowania produktów jest mniejszy, czy większy od tego, jaki wykazywały substraty. Aby obliczyć zmianę entropii towarzyszącą reakcji chemicznej, korzysta się z entropii reagentów. Różnicę entropii produktów i substratów, które znajdują się w stanie standardowym, nazywamy standardową entropią reakcji, . Chcąc obliczyć zmianę entropii danej reakcji czy przemiany fazowej, należy zsumować każdą entropię standardową wszystkich produktów, pomnożoną przez liczbę produktów (współczynnik stechiometryczny danego produktu) i od tej sumy odjąć tak samo wyliczoną sumę substratów.
Dla danej reakcji chemicznej:
Gdzie , , i oznaczają współczynniki stechiometryczne reagentów.
Przykład
Obliczmy zmianę entropii, przy dla reakcji, w której mocznik powstaje z amoniaku i tlenku węgla():
korzystając z ze standardowych entropii molowych:
Wyliczymy ją ze wzoru:
i będzie wynosić:
Słownik
termodynamiczna funkcja stanu, miara stopnia nieuporządkowania układu i rozproszenia energii
część przestrzeni materialnej, będącej przedmiotem rozważań; pozostała część przestrzeni jest otoczeniem
część lub całość układu, która wykazuje w całej swej masie jednakowe własności fizyczne i chemiczne (w szczególności jednakowe równanie stanu) i jest odgraniczona wyraźnie od reszty układu (otoczenia)
samorzutna przemiana jednej fazy w drugą
układ, w którym niemożliwa jest wymiana materii i energii pomiędzy układem a otoczeniem
układ, w którym możliwa jest wymiana energii pomiędzy układem a otoczeniem, a niemożliwa jest wymiana materii
Bibliografia
Atkins P. W., Chemia fizyczna, Warszawa 2006.
Gumiński K., Termodynamika, wyd. 3, Warszawa 1974.
Orear J., Fizyka, Warszawa 1993.
Stauffer D., Stanley H. E., Od Newtona do Mandelbrota, Warszawa 1996.