Przeczytaj
O tym, w jaki sposób i jakie związki tworzy brom, decyduje budowa atomu bromu. Posiada on 35 elektronów, rozmieszczonych w stanie podstawowym na czterech powłokach elektronowych, z czego na czwartej, zewnętrznej powłoce rozmieszczonych jest siedem elektronów walencyjnych.
Z konfiguracji elektronowej bromu wynika, że może on tworzyć związki na stopniu utlenienia –I (może przyjąć lub uwspólnić elektron, który znajduje się na podpowłoce ) lub od I do VII (może oddać elektrony znajdujące się na podpowłokach i ).
Na postawie konfiguracji elektronowej bromu określ, do jakiej najkorzystniejszej konfiguracji elektronowej będą dążyć atomy bromu?
Związki bromu z wodorem i metalami
Bromowodór
Bromowodór () jest gazem o ostrym, charakterystycznym zapachu, dobrze rozpuszcza się w wodzie. Powstały kwas bromowodorowy jest kwasem mocnym i jest wkorzystywany do syntezy bromków metali.
Bromki metali
Brom z metalami tworzy bromkibromki. Są to substancje krystaliczne, z których większość dobrze rozpuszcza się w wodzie. Słabo rozpuszczalny w wodzie jest np. bromek srebra i bromek ołowiu. Z punktu widzenia chemicznego, są to sole, zawierające w swojej strukturze resztę kwasu bromowodorowego.
To właśnie z bromków, występujących w przyrodzie, pozyskuje się brom. Są to głównie bromek sodu () i bromek potasu (), które wchodzą w skład wody morskiej i słonych jezior.
Kwasy tlenowe bromu i ich sole
Brom tworzy kwasy tlenowe. Moc kwasów bromowych i ich właściwości utleniające rosną wraz ze wzrostem stopnia utlenienia bromu.
stopnie utlenienia bromu w związkach chemicznych | wzór sumaryczny kwasu | wzór strukturalny | moc kwasów tlenowych | właściwości utleniające kwasów | nazwa bromianubromianu |
|---|---|---|---|---|---|
I | 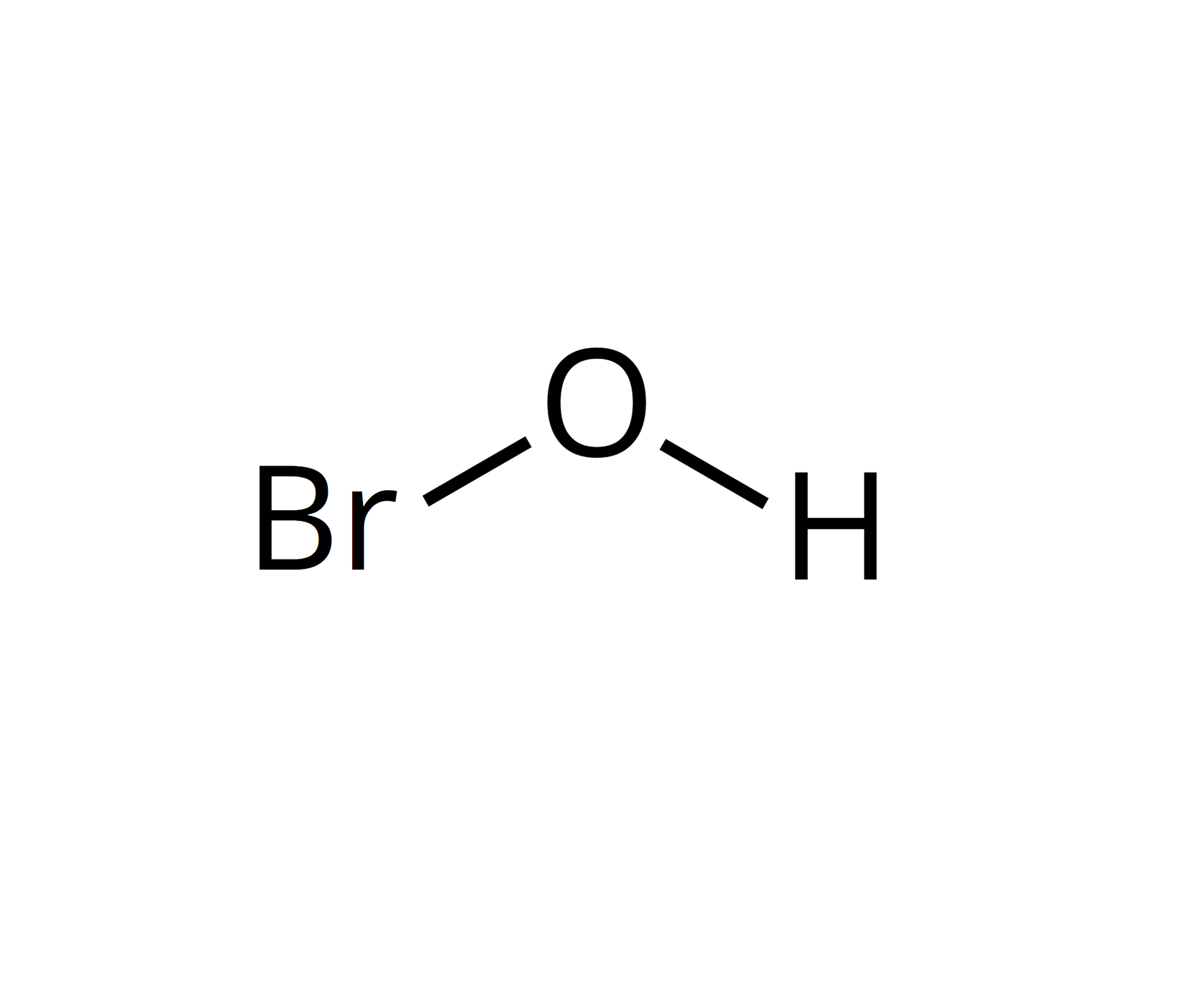 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | bromian(I) | |
III | 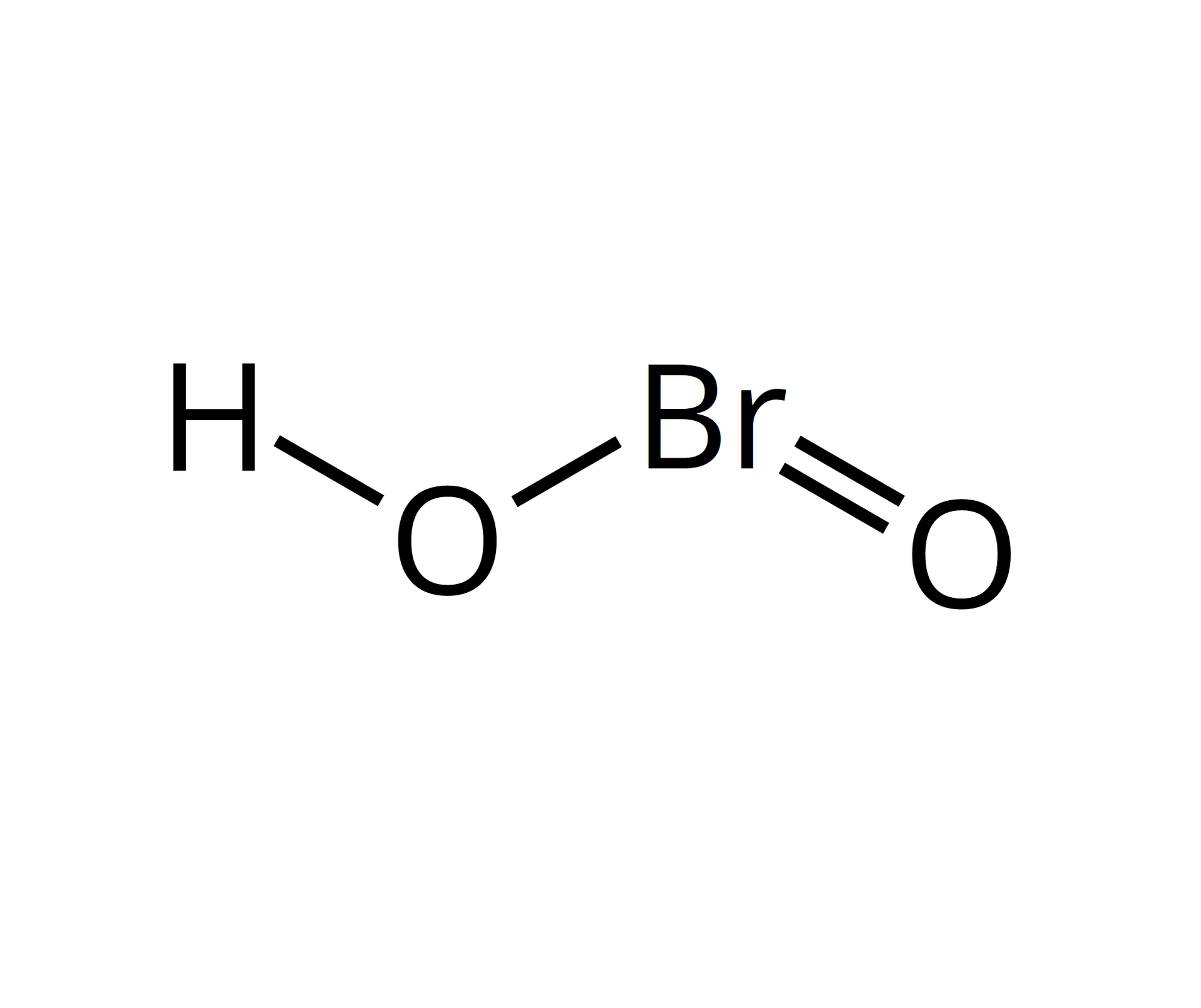 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | bromian(III) | |||
V | 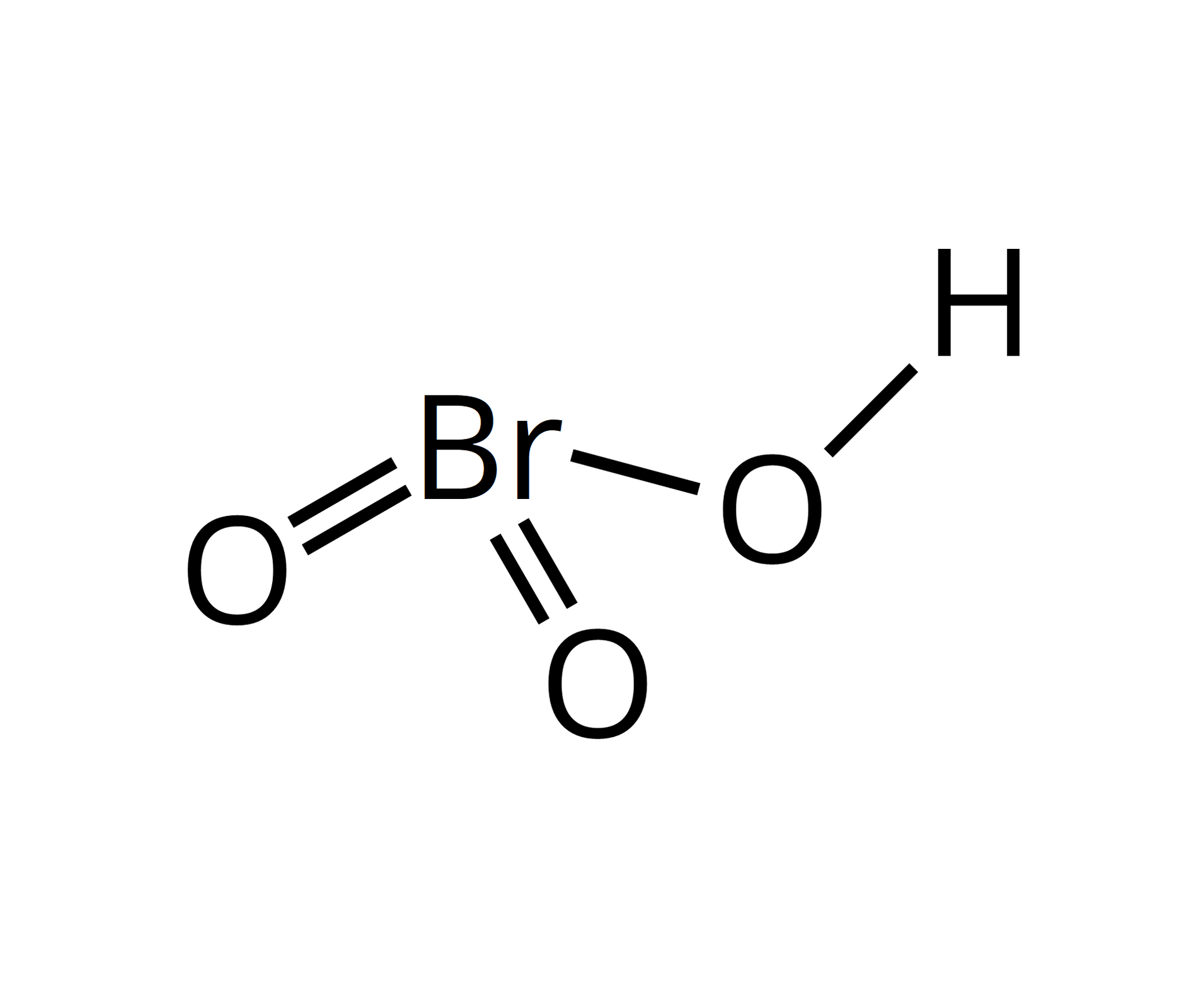 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | bromian(V) | |||
VII | 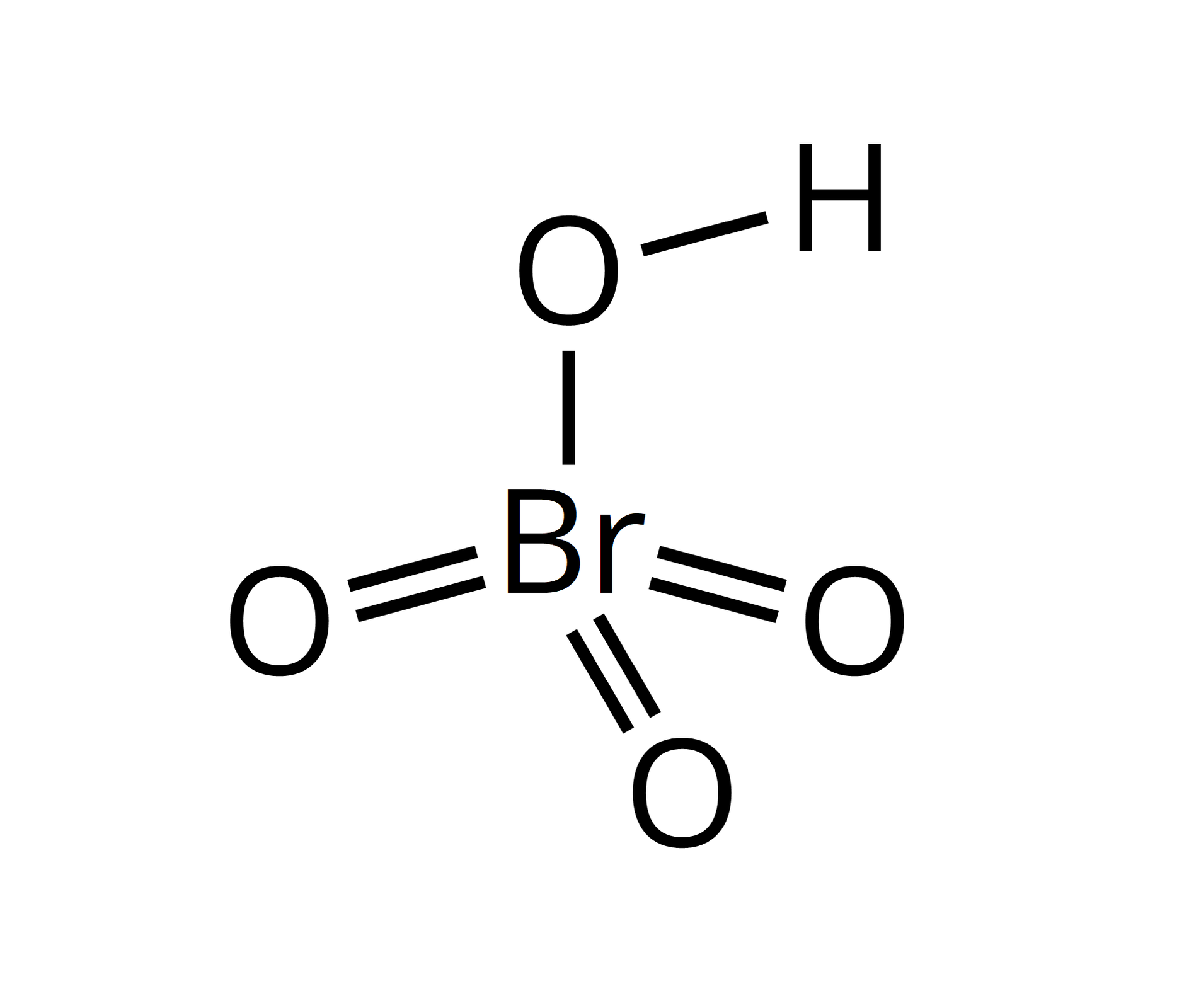 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | bromian(VII) |
Związki pomiędzy fluorowcami posiadają właściwości pośrednie między właściwościami pierwiastków, które je tworzą. W przypadku bromu, entalpia wiązania jest stosunkowo mała i związki bromu z fluorem są bardzo reaktywne. Przykładowo, trifluorek bromu () jest tak reaktywny, że powoduje zapalenie się azbestu.
wzór | nazwa | postać (przy 25°C, 1 atm) |
|---|---|---|
fluorek bromu | jasnobrunatny gaz | |
trifluorek bromu | bezbarwna ciecz | |
pentafluorek bromu | bezbarwna ciecz | |
chlorek bromu | żółty gaz | |
bromek jodu | czarna substancja stała |
Słownik
związki bromu, w których brom występuje na -I stopniu utlenienia; sole kwasu bromowodorowego – zarówno nieorganiczne, jak i organiczne
sole tlenowych kwasów bromu; substancje krystaliczne; bromiany(I) (podbrominy), o anionie ; nietrwałe (znane w roztworach wodnych); bromiany(III) (brominy), sole zawierające anion ; bromiany(V) (bromiany), zawierające anion ; bromiany(VII) (nadbromiany), sole o anionie ; bromiany są wykorzystywane jako środki utleniające, a bromiany(V) także jako odczynniki analityczne
sposób postępowania w analizie ilościowej, który polega na dodawaniu (małymi porcjami) mianowanego roztworu (tritantu) do roztworu oznaczanej substancji (analitu)
Bibliografia
Atkins P. Jones L., Chemia ogólna, Warszawa 2004, s.951‑958.
Encyklopedia PWN
Kałuża B., Kamińska F., Chemia. Część 1. Podręcznik. Zakres rozszerzony, Warszawa 2013, s. 302‑303.
Litwin M., Styka‑Wlazła Sz., Szymońska J., Chemia ogólna i nieorganiczna, Część 1. Podręcznik dla liceum, Warszawa 2004, s. 295‑303.


