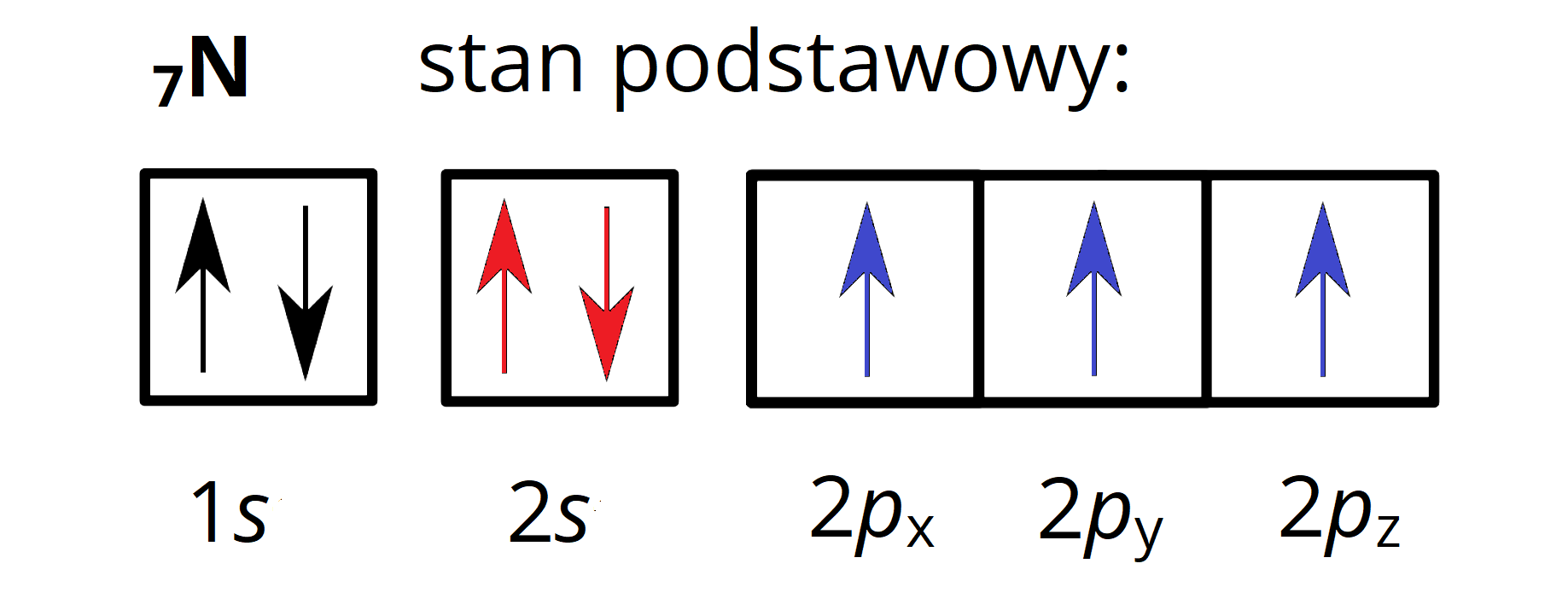
Przeczytaj
Orbitale molekularne
Podobnie jak tłum na placu, który zajmuje określone miejsce, tak i elektrony zajmują konkretne pozycje (orbitale). Zdarza się jednak, że są osamotnione. Mówimy wówczas o elektronach niesparowanych. Są one zdolne do utworzenia wiązania z tym samym bądź innym atomem. Na skutek oddziaływania między atomami i uwspólnienia zajmowanych przez elektrony pozycji, dochodzi do ich sparowania. W ten sposób powstaje wiązanie chemiczne, a zajmowana przez elektrony przestrzeń tworzy tzw. orbital molekularnyorbital molekularny. Jego powstanie można porównać do spotkania dwojga ludzi w tłumie na placu, którzy zajmują wspólną przestrzeń.
Aby zrozumieć dokładniej proces powstawania wiązań pomiędzy atomami, z pomocą przychodzi mechanika kwantowamechanika kwantowa. Teoria kwantowa, oparta na obliczeniach matematycznych, zakłada, że wiązanie kowalencyjne powstaje w wyniku nakładania się orbitali. Powstający charakterystyczny rozkład gęstości elektronowej – orbital molekularny – określany jest jako wiązanie [czyt. sigma] lub wiązanie [czyt. pi], w zależności od sposobu nakładania się orbitali.
W atomie mogą występować orbitale , , , . Zgodnie z kwantową teorią wiązań chemicznych, orbital molekularny (cząsteczkowy) jest funkcją falową, która odpowiada elektronowi w cząsteczce i może obejmować dwa lub więcej atomów tego samego pierwiastka lub innych. Orbitale molekularne typu powstają w wyniku bocznego nakładania się wszystkich rodzajów orbitali atomowych (z wyjątkiem orbitali typu ).
Prześledźmy na przykładach sposób powstawania orbitali molekularnych typu .
Wiązanie w cząsteczkach homojądrowych
W cząsteczkach homojądrowych, jak czy , wiązanie chemiczne tworzy się na skutek wzrostu gęstości elektronowej w obszarze międzyjądrowym. Ile i jakiego typu orbitale tworzą wiązania atomowe w wymienionych cząsteczkach?
Zastanów się, czy orbitale cząsteczkowe, które powstają w wyniku czołowego nałożenia orbitali atomowych, mają taki sam kształt jak te, które powstają z nałożenia bocznego?


Przykład 1. Powstawanie wiązań w cząsteczce
Cząsteczka tlenu () powstaje poprzez nałożenie się chmur elektronowych dwóch atomów tlenu. W stanie podstawowym atom tlenu posiada konfigurację elektronową , z czego dwa niesparowane elektrony znajdują się na orbitalu oraz . Są to elektrony, które tworzą orbitale molekularne w cząsteczce. W wyniku nałożenia się dwóch rodzajów orbitali atomowych ze sobą, pomiędzy atomami tlenu tworzy się wiązanie podwójne ( wiązanie typu oraz jedno wiązanie typu ). W galerii mediów zaprezentowano sposób powstania wiązań w cząsteczce . Zwróć uwagę na kształty utworzonych orbitali molekularnych.


Z zaprezentowanych ilustracji wynika, że w cząsteczce tlenu utworzone wiązanie podwójne składa się z jednego wiązania typu i jednego wiązania typu . Utworzone orbitale molekularne oraz mają odmienny kształt.
Zastanów się, jak powstaje cząsteczka azotu ()? Ile wiązań i jakiego typu powstanie, gdy nałożą się na siebie: po dwa orbitale atomowe typu , oraz ?
Wiązanie w cząsteczkach heteroatomowych
Istotnym przykładem tworzenia wiązań typu jest sytuacja, gdy tylko część z orbitali atomowych ulega hybrydyzacjihybrydyzacji. Pozostałe niehybrydyzowane orbitale mają zdolność do tworzenia wiązań . Poniżej przykład powstawania orbitalu molekularnego w cząsteczce o hybrydyzacji atomu centralnego.
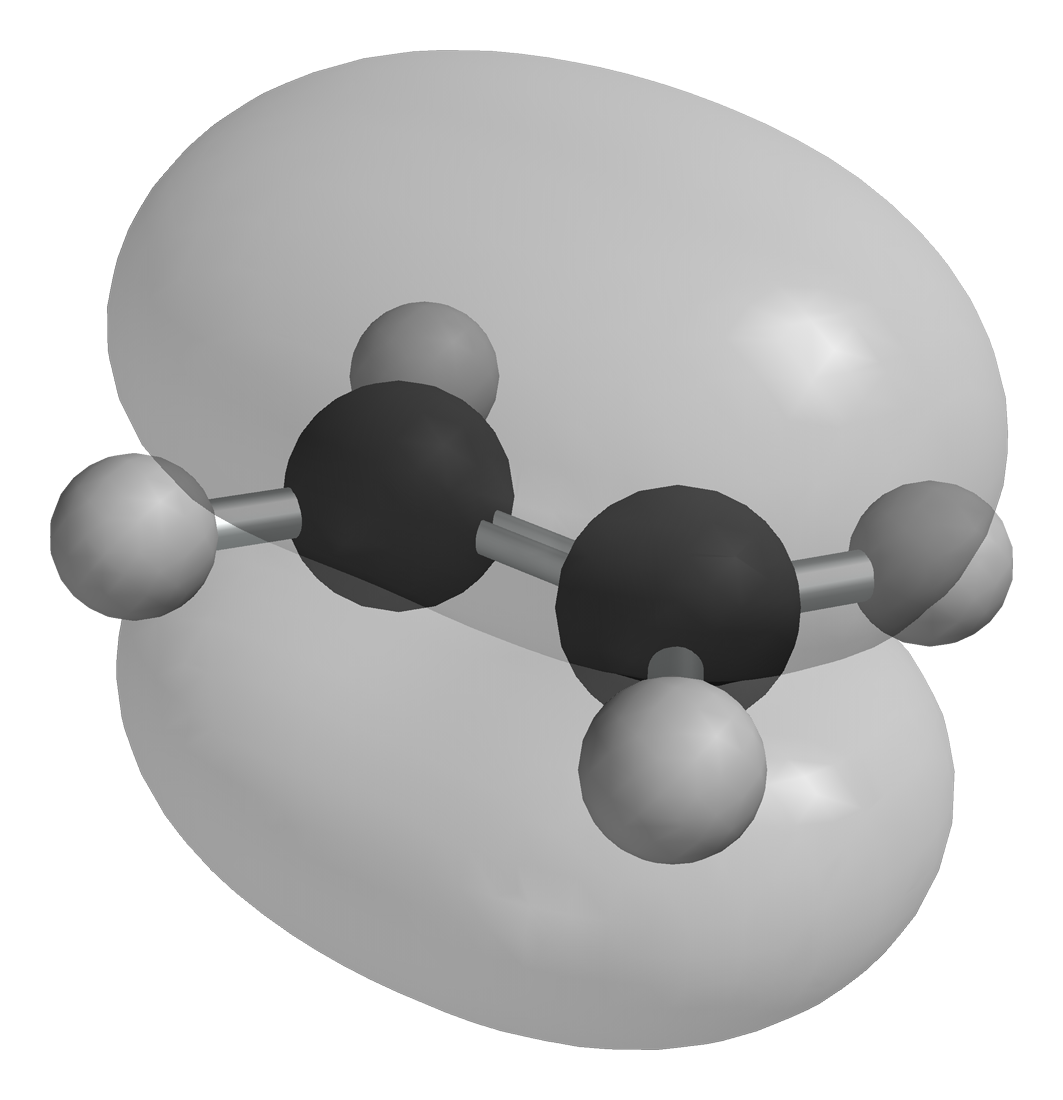

Przykład 2 – Wiązanie w cząsteczce etenu
Jak powstają wiązania typu w cząsteczce etenu? Jak myślisz, które z zaprezentowanych na poniższym rysunku wiązań jest wiązaniem typu ?
Jak powstają wiązania typu w cząsteczce etenu? Zapoznaj się z opisem rysunku. Jak myślisz, które z wiązań jest wiązaniem typu ?

Wiązanie w wiązaniu podwójnym wynika z nakładania się trzeciego (pozostałego) orbitalu na każdym atomie węgla, który nie uczestniczy w hybrydyzacji. Ten niezhybrydyzowany orbital (płaty pokazane na pomarańczowo) jest prostopadły do płaszczyzny orbitali zhybrydyzowanych . Tak niezhybrydyzowane orbitale zachodzą na siebie, powyżej i poniżej osi między jądrowej, oraz tworzą wiązanie .
Co istotne, wiązanie jest wiązaniem pojedynczym, ponieważ bierze w nim udział jedna para elektronów, wspólna dla dwóch atomów. Natomiast kombinacja jednego wiązania i jednego wiązania odpowiada za występowanie wiązania podwójnego między atomami węgla.
Z kolei wiązania , pomiędzy atomem węgla a atomem wodoru, powstają przez nakładanie się orbitalu typu atomu węgla z orbitalem typu wodoru.

Przykład 3. Powstawanie wiązań w cząsteczce

Atom węgla przyjmuje hybrydyzację typu . Jednocześnie dwa orbitale typu ( oraz ) pozostają niezhybrydyzowane i są zdolne do tworzenia wiązań z atomami tlenu. Z kolei atomy tlenu ulegają hybrydyzacji . Każdy atom tlenu posiada zatem po jednym niezhybrydyzowanym orbitalu typu . W wyniku zbliżania się do siebie zhybrydyzowanych orbitali (od atomu węgla) oraz (od atomów tlenu), następuje ich czołowe nakładanie i przenikanie w jedną chmurę, która obejmuje oba atomy. W ten sposób powstaje wiązanie typu . Elektrony orbitali oraz atomu węgla tworzą z orbitalami typu atomów tlenu dwa wiązania typu . Po jednym z każdej strony atomu węgla.

Podsumowanie
Wiązanie jest wiązaniem utworzonym przez elektrony, które opisują kilka rodzajów orbitali molekularnych. Wiązania powstają poprzez boczne nałożenie się orbitali atomowych typu lub .
Krotność wiązania jest ustalana w zależności od rodzaju orbitali molekularnych, jakie je tworzą. Pamiętaj że:
;
;
.
Różnicą istotną, pomiędzy wiązaniem typu oraz wiązaniem typu , jest to, z jaką siłą wiążą się ze sobą atomy. Orbitale molekularne typu tworzą wiązania silniejsze od wiązań typu . Jak wynika z przedstawionych przykładów, wiązanie powstaje w wyniku bocznego nakładania dwóch orbitali typu ( lub ), obsadzonych niesparowanymi elektronami. Z kolei wiązanie powstaje poprzez czołowe zbliżenie i nakładanie się orbitali, obsadzonych niesparowanymi elektronami o przeciwnych spinach. W zależności od typu nakładających się orbitali, wyróżniamy orbital molekularny: , , .
Pamiętaj, wiązanie nigdy nie występuje samodzielnie, lecz zawsze towarzyszy wiązaniu .
Słownik
powstaje w wyniku „czołowego” nakładania się orbitali (), (), lub i ()
powstaje w wyniku „bocznego” nakładania się orbitali lub
elektrony wartościowości; elektrony zapełniające w atomie danego pierwiastka tzw. orbitale walencyjne, tzn. orbitale o największej dla tego atomu wartości energii (w stanie podstawowym)
fundamentalna teoria fizyczna opisująca ruch mikroobiektów np. atomów, elektronów
funkcja falowa, opisująca stan jednego elektronu w atomie (orbital atomowy) lub w cząsteczce (orbital molekularny, orbital cząsteczkowy); są wynikiem mieszania się orbitali atomowych o różnych kształtach i energii
(łac. hybrida „mieszaniec”) w chemii kwantowej tworzenie kombinacji liniowych orbitali atomowych powłoki walencyjnej
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Czerwiński A., Czerwińska A., Jeziorna M., Kańska M., Chemia 3. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2004.
Encyklopedia PWN
Hassa R., Mrzigod A., Mrzigod J., Sułkowski W., Chemia 1. Podręcznik i zbiór zadań w jednym, Warszawa 2003.
Hoffman K. B., Pi and sigma bonding in organic compounds 1960, 37, 12.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, Warszawa 1985.
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa 2003.