Przeczytaj
Korozja metali
KorozjaKorozja metali jest procesem ich niszczenia. Jest spowodowana różnymi czynnikami. Może zachodzić w wyniku reakcji chemicznych metali ze związkami, które znajdują się w ich otoczeniu lub w procesie elektrochemicznym.
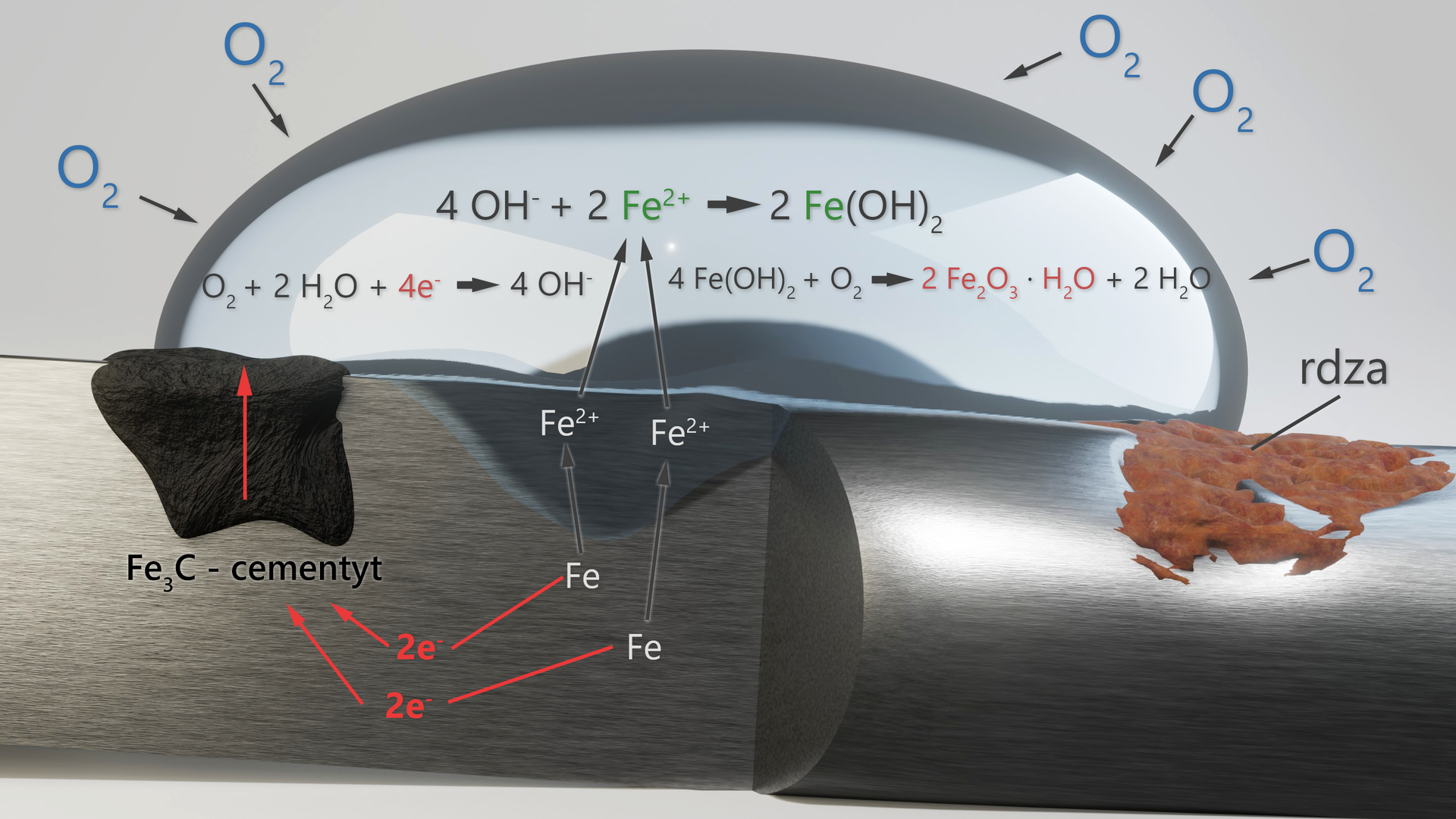
Największe straty gospodarcze przynosi elektrochemiczna odmiana korozji, niszcząca stopystopy żelaza – czystego żelaza, które koroduje stosunkowo powoli. Nie sposób go wówczas użyć jako materiału konstrukcyjnego. Stopy żelazaStopy żelaza, różne gatunki stali i żeliwa zawierają dodatek grafitu. Kryształy grafitu oraz cementytucementytu () tworzą z żelazem ogniwa galwaniczne. W obecności elektrolitu (woda wraz z rozpuszczonymi gazami i solami), który powoduje zamknięcie obwodu, zaczynają zachodzić niekorzystne procesy korozyjne.
Żelazo w mikroogniwie jest zawsze anodą (elektrodą ujemną), natomiast grafit lub cementyt, które mają wyższe potencjały niż żelazo, są katodami (elektrodami dodatnimi).
Na anodzie żelazowej (-) utlenieniu ulega żelazo:
Na katodzie (+) redukcji ulega tlen rozpuszczony w wodzie:
Sumarycznie:
Wodorotlenek żelaza(II) ulega utlenieniu pod wpływem tlenu atmosferycznego do połączeń żelaza(III) o brunatnym zabarwieniu, czyli rdzy:
Badania korozyjne
Takie badania prowadzi się w celu określenia szybkości korozji i stopów metali, właściwości ochronnych powłok, wpływu środowiska na zmiany właściwości mechanicznych materiałów itp. Bada się również oddziaływanie takich czynników, jak temperatura, wilgotność, stężenie składników korozyjnych (np. , , amoniak, kwasy, chlorki).
Stosuje się często takie metody oceny korozji, jak:
metodę wizualną oceny zmian wyglądu powierzchni;
metodę wagową oceny zmiany masy i wymiarów.
Dopisz hipotezę do poniższego opisu eksperymentu. Zapisz obserwacje oraz wnioski.
Materiały:
Odczynniki:
Hipoteza:
Eksperyment:
Umieszczony w probówce metal należy do połowy zalać następującymi roztworami:
Probówka 1. woda destylowana + gwóźdź;
Probówka 2. roztwór 2% + gwóźdź;
Probówka 3. roztwór 2% kwasu octowego + gwóźdź;
Probówka 4. roztwór 2% + gwóźdź owinięty drutem miedzianym.
Odczekać 24 godziny.
Obserwacje i wnioski
Ochrona przed korozją
Znajomość mechanizmu korozji elektrochemicznej oraz czynników, które wpływają na szybkość tego procesu, umożliwiają zastosowanie środków zapobiegawczych. Oprócz używania materiałów odpornych na korozję (tworzywa sztuczne, stal nierdzewna, trudno korodujące metale) stosuje się także m.in.:
izolacje powierzchni stali od czynników środowiskowych za pomocą niemetalicznych powłok ochronnych: farb, lakierów, emalii;
metaliczne powłoki ochronne z metali stojących w szeregu napięciowym przed żelazem (cynk, chrom); rożne metale, połączone ze sobą, tworzą ogniwa – ten bardziej aktywny zawsze jest anodą i ulega zniszczeniu w agresywnym środowisku, chroniąc mniej aktywny, czyli katodę.

Dopisz hipotezę do poniższego opisu eksperymentu. Zapisz obserwacje oraz wnioski.
Materiały:
Odczynniki:
Hipoteza:
Eksperyment:
Umieszczony w probówce metal należy do połowy zalać następującymi roztworami:
Probówka 1. woda destylowana + gwóźdź;
Probówka 2. woda destylowana + kilka kryształków + gwóźdź;
Probówka 3. woda destylowana + kilka kryształków + gwóźdź;
Probówka 4. roztwór 2% + gwóźdź;
Probówka 5. woda destylowana + gwóźdź owinięty blaszką cynkową.
Odczekać 24 godziny.
Obserwacje i wnioski
Słownik
substancja, która składa się z dwóch lub więcej pierwiastków chemicznych, z czego co najmniej jeden, ale występujący w przeważającej ilości, jest metalem
stopy, których główym składnikiem jest żelazo, a dodatkami stopowymi są różne pierwiastki metaliczne i niemetaliczne
węglik żelaza ; składnik strukturalny wielu stopów żelaza
proces niszczenia metali lub innych materiałów, przebiegający podczas ich zetknięcia się z otaczającym je środowiskiem
Bibliografia
J. Kaczyński, A. Czaplicki, Chemia ogólna, Warszawa 1974.
A. Bielański, Podstawy chemii nieorganicznej, Warszawa 1987.
A. Bogdańska‑Zarembina, E.I. Matusewicz, J. Matusewicz, Chemia dla szkół średnich, Warszawa 1997.
M. Litwin, S. Styka‑Wlazło, J. Szymońska, Chemia ogólna i nieorganiczna, Warszawa 2013.
K.M. Pazdro, Chemia podręcznik do kształcenia rozszerzonego w liceach, Warszawa 2014.