Przeczytaj
Rzędowość amin
AminyAminy to związki chemiczne pochodzące od węglowodorów oraz amoniaku, których wzór ogólny – w przypadku amin -rzędowych – można przedstawić następująco:
Rzędowość amin określa liczba grup alkilowychgrup alkilowych lub arylowycharylowych (, , ), łączących się bezpośrednio z atomem azotu i zastępujących atomy wodoru w cząsteczce amoniaku. Można zatem potraktować aminy jako pochodne amoniaku, w których cząsteczkach co najmniej jeden atom wodoru został zastąpiony grupą węglowodorową.
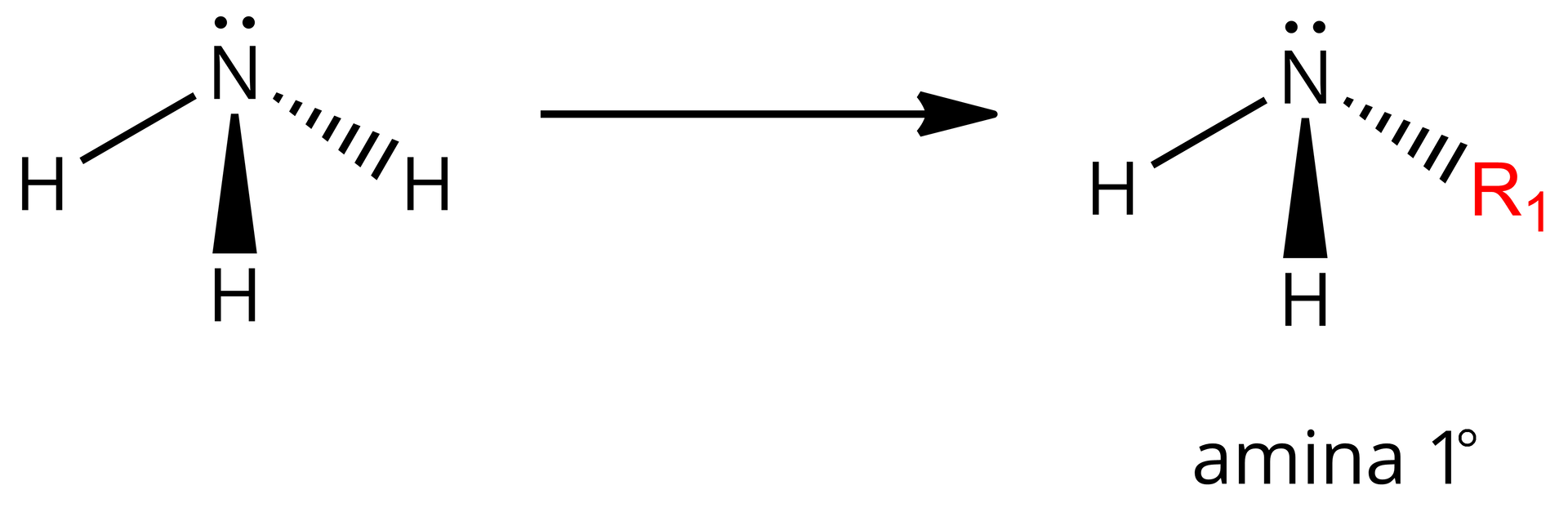
W aminach pierwszorzędowych (, -rzędowe) jeden atom wodoru został zastąpiony grupą węglowodorową (). Grupą funkcyjną amin pierwszorzędowych jest grupa aminowa ().
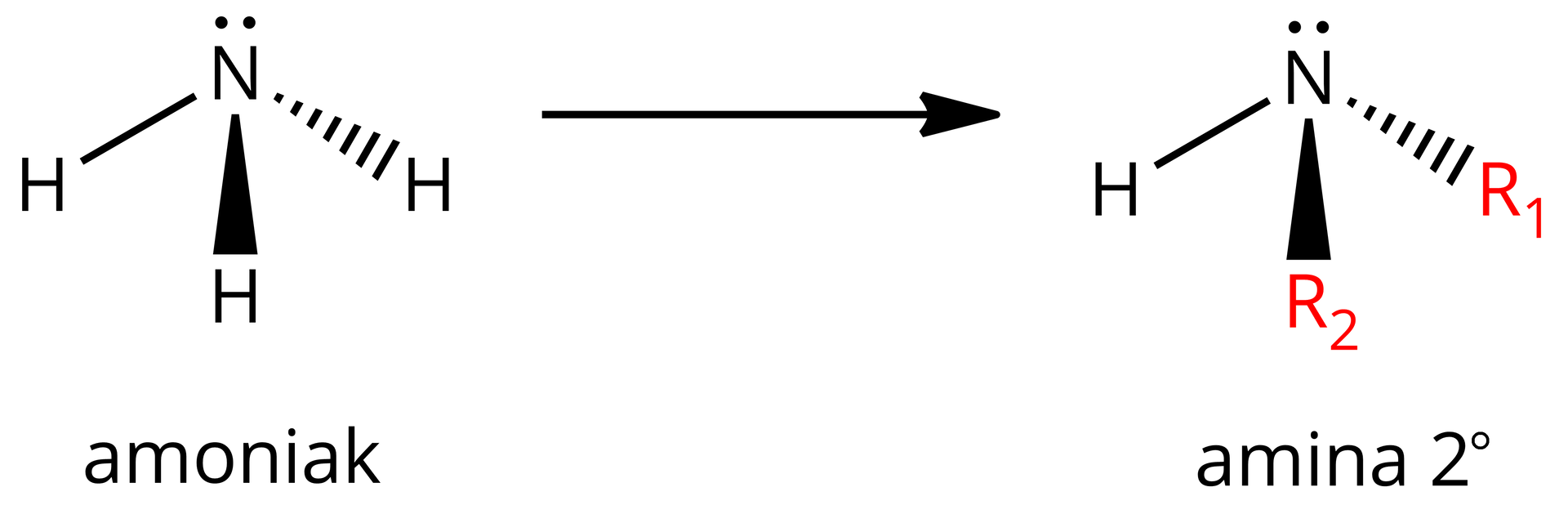
Zastępując dwa atomy wodoru grupami węglowodorowymi (grupy , mogą być takie same lub różne) w cząsteczce amoniaku, otrzymujemy wzór aminy drugorzędowej (, -rzędową) z grupą iminową () jako grupą funkcyjną.
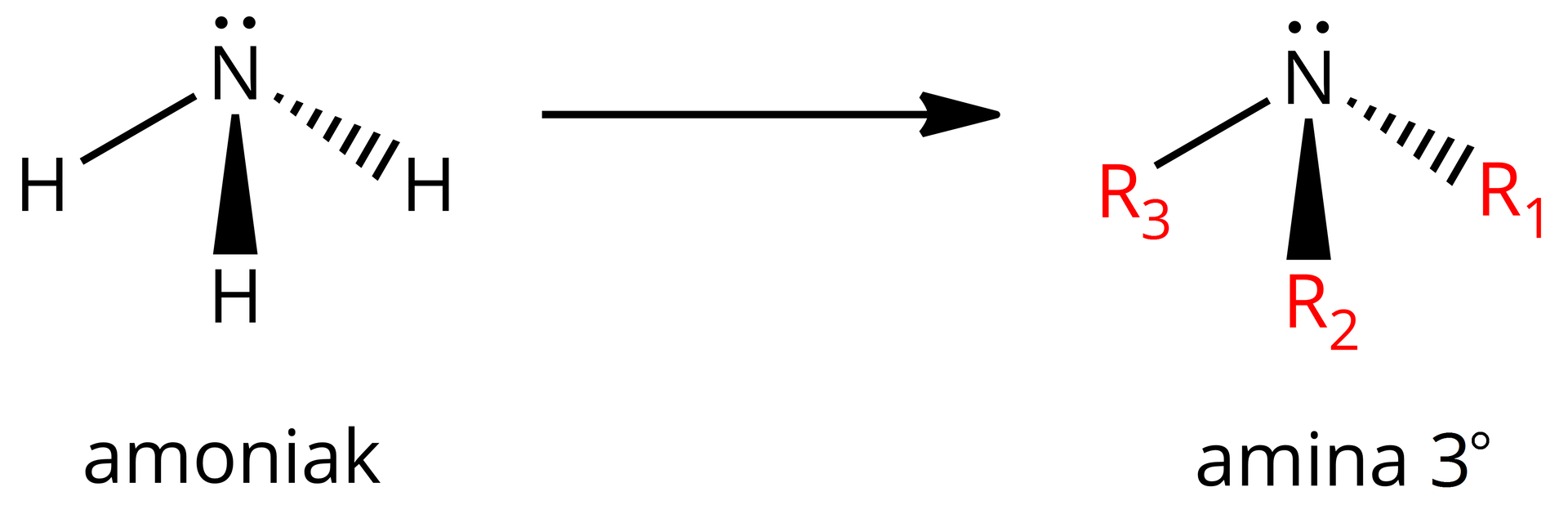
Jeśli wszystkie trzy atomy wodoru w cząsteczce amoniaku podstawione zostaną grupami węglowodorowymi (grupy , , mogą być takie same lub różne), uzyskuje się aminę trzeciorzędową (, -rzędową).
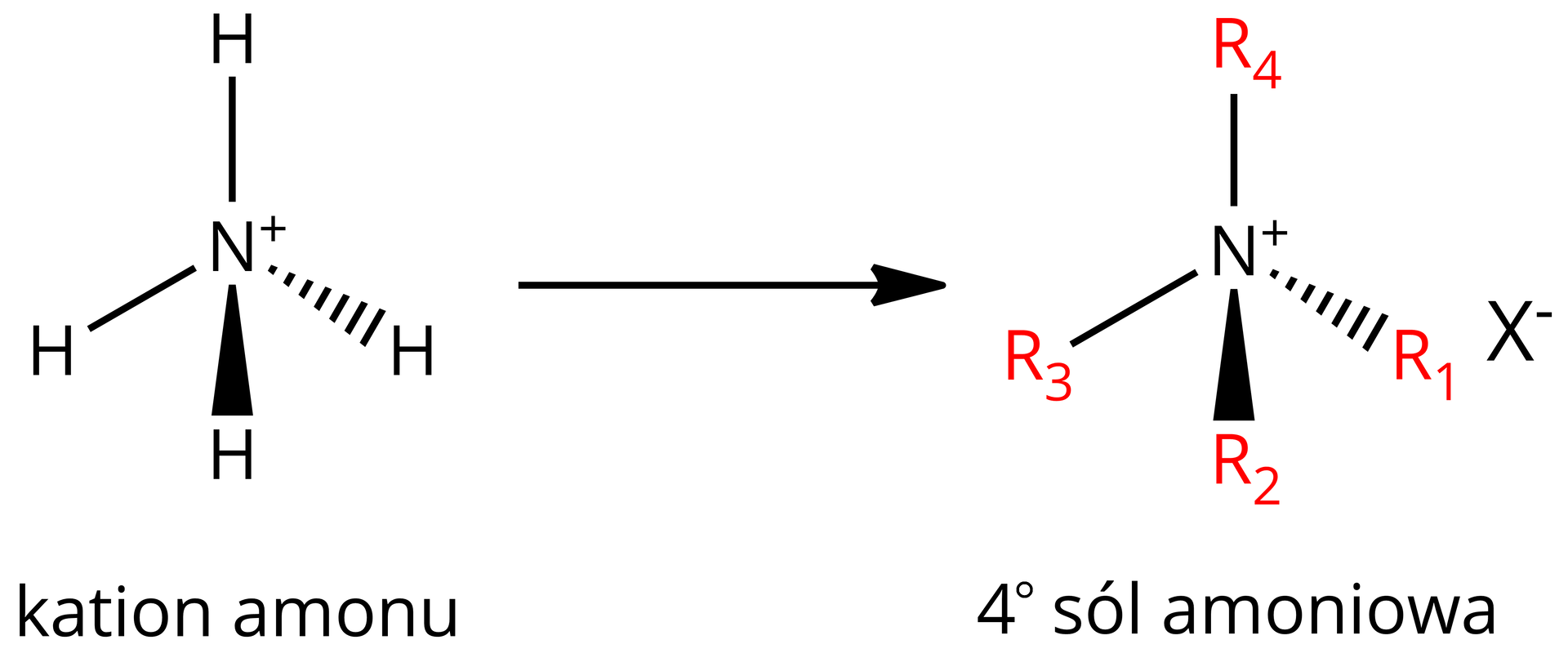
Warto również wspomnieć, że istnieją związki, w których do atomu azotu dołączone są cztery grupy węglowodorowe, ale wówczas na atomie azotu pojawia się ładunek dodatni. Takie związki to czwartorzędowe sole amoniowe (gdzie to anion reszty kwasowej), pochodzące od jonu amonowego.
Hybrydyzacja
Orbitale walencyjne atomu azotu w cząsteczce aminy są w stanie hybrydyzacji oraz posiadają jedną wolną parę elektronową, dlatego tak jak w przypadku amoniaku, aminy mają kształt piramidy trygonalnej. Atom azotu w cząsteczce aminy posiada trzy podstawniki, które zajmują trzy wierzchołki tetraedru, a wolna para elektronowa zajmuje czwarty wierzchołek. Kąt między wiązaniami oscyluje wokół typowej wartości kąta dla tetraedru (), ale jego dokładna wartość zależy od podstawników w danej aminie. Przykładowo, dla najprostszej aminy -rzędowej kąt między wiązaniami wynosi , a długość wiązania to .
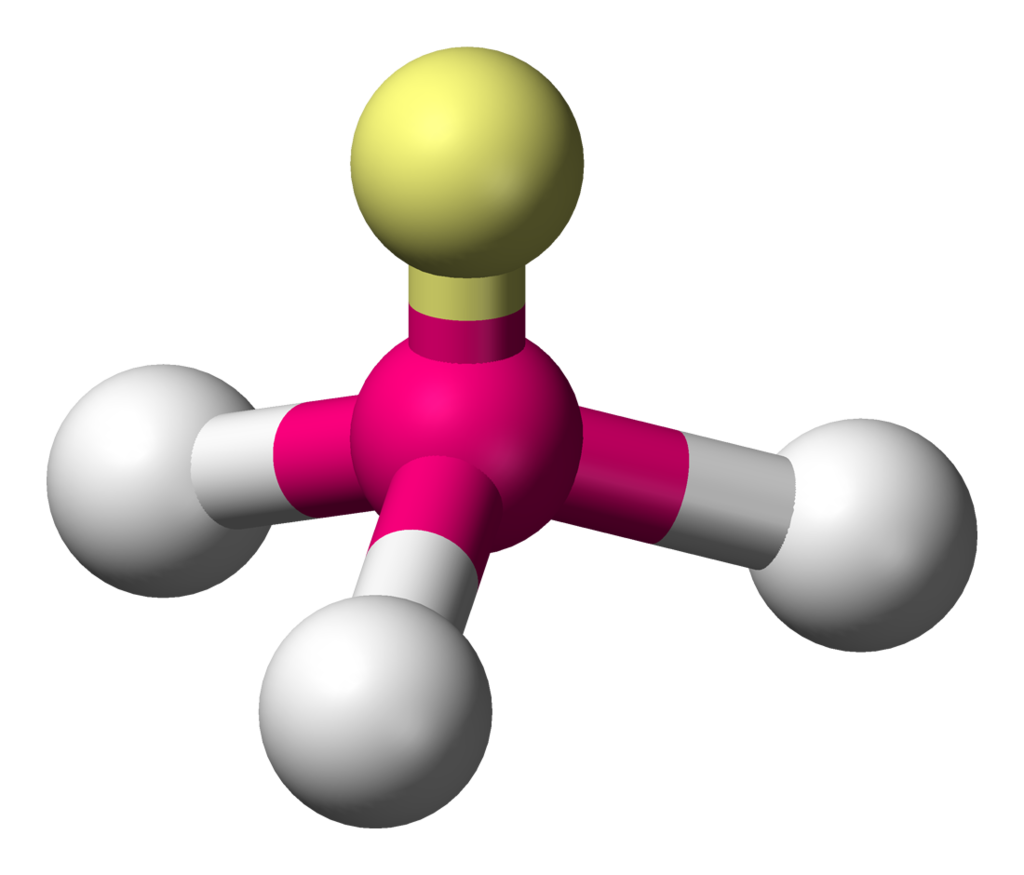
Powstawanie czwartorzędowej soli amoniowej jest możliwe dzięki wolnej parze elektronowej atomu azotu. Pomiędzy atomem azotu a atomem kolejnego podstawnika powstaje wiazanie koordynacyjne.
Wykorzystanie wolnej pary elektronowej atomu azotu do stworzenia kolejnego wiązania nie zmienia typu hybrydyzacji tego atomu, a jedynie kształt cząsteczki. Zatem czwartorzędowe sole amoniowe mają kształt tetraedru.
Poniżej podano przykłady amin alifatycznychamin alifatycznych oraz aromatycznycharomatycznych należących do poszczególnych grup:
Amina ‑rzędowa | Amina ‑rzędowa | Amina ‑rzędowa |
|---|---|---|
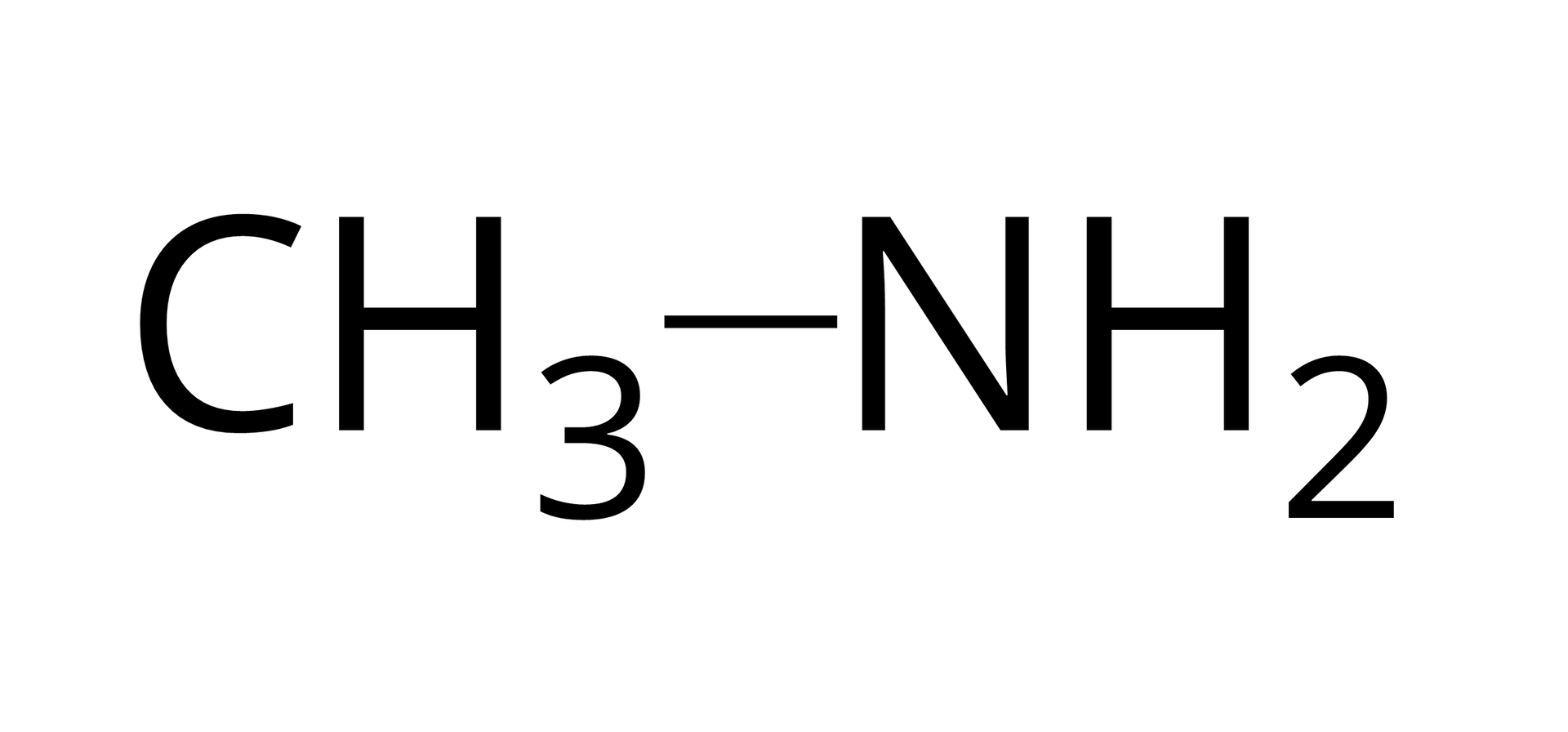 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. metanoamina |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. N‑metylometanoamina | 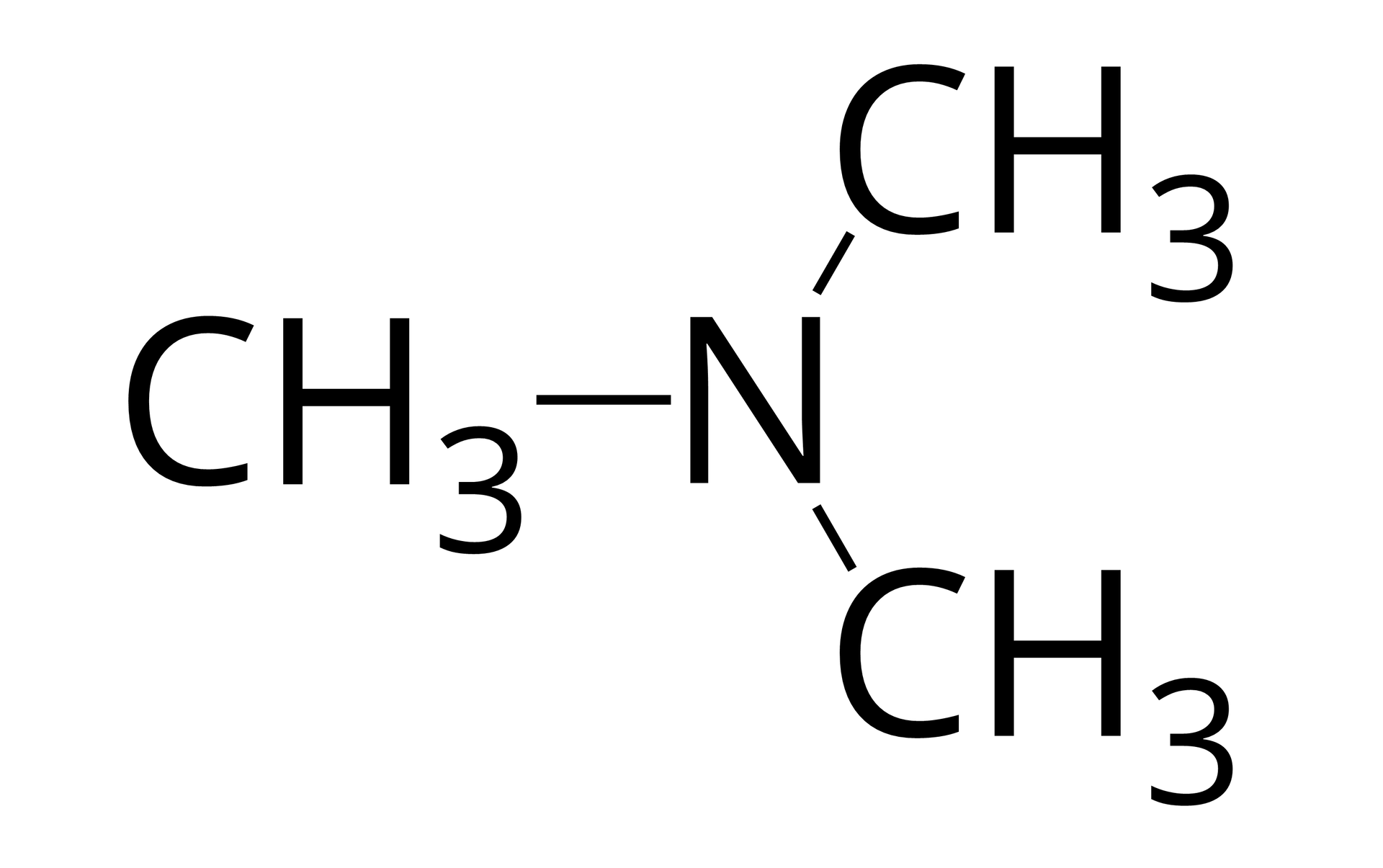 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. N,N‑dimetylometanoamina |
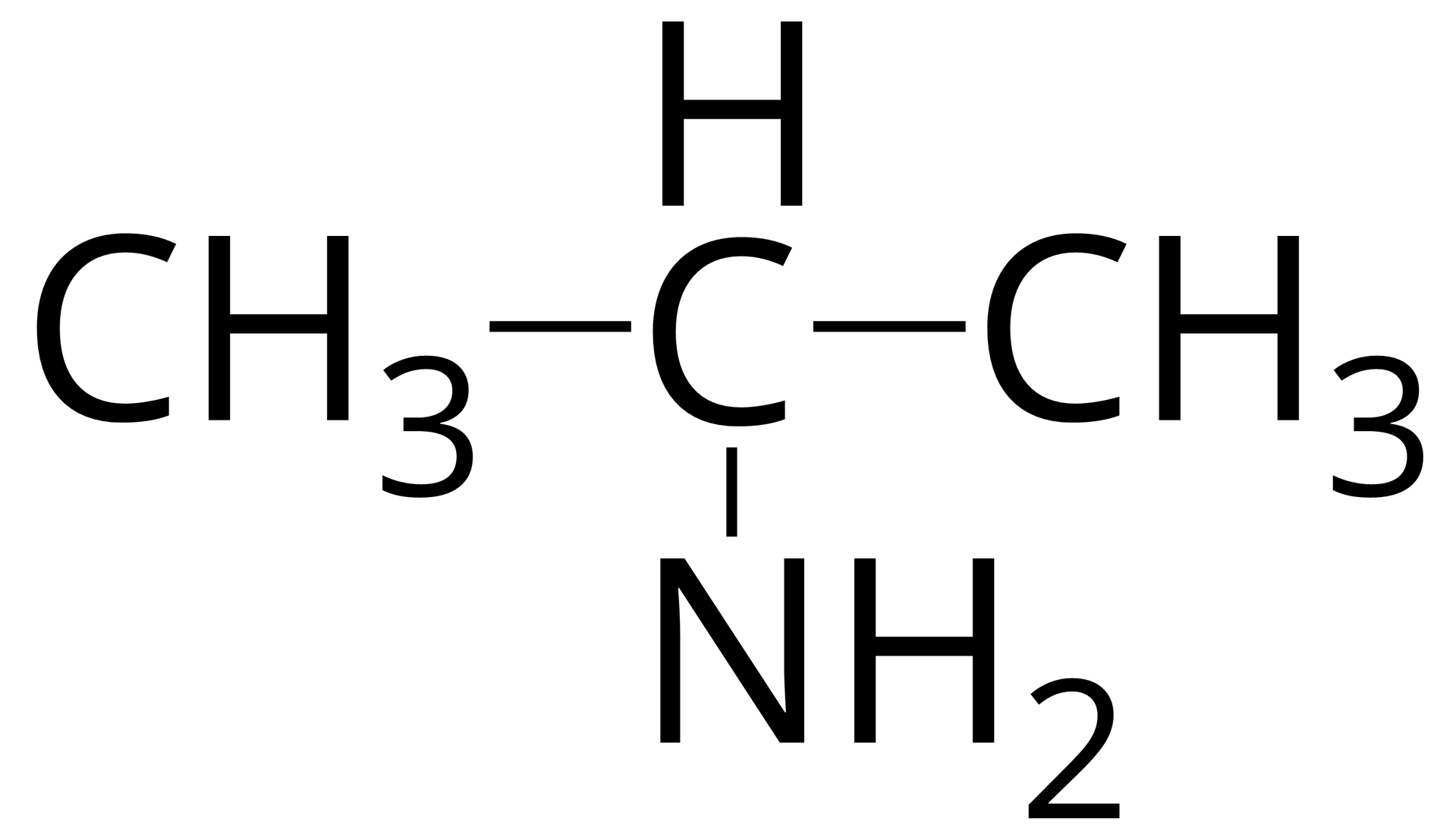 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. propano‑‑amina |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. N‑metyloetanoamina | 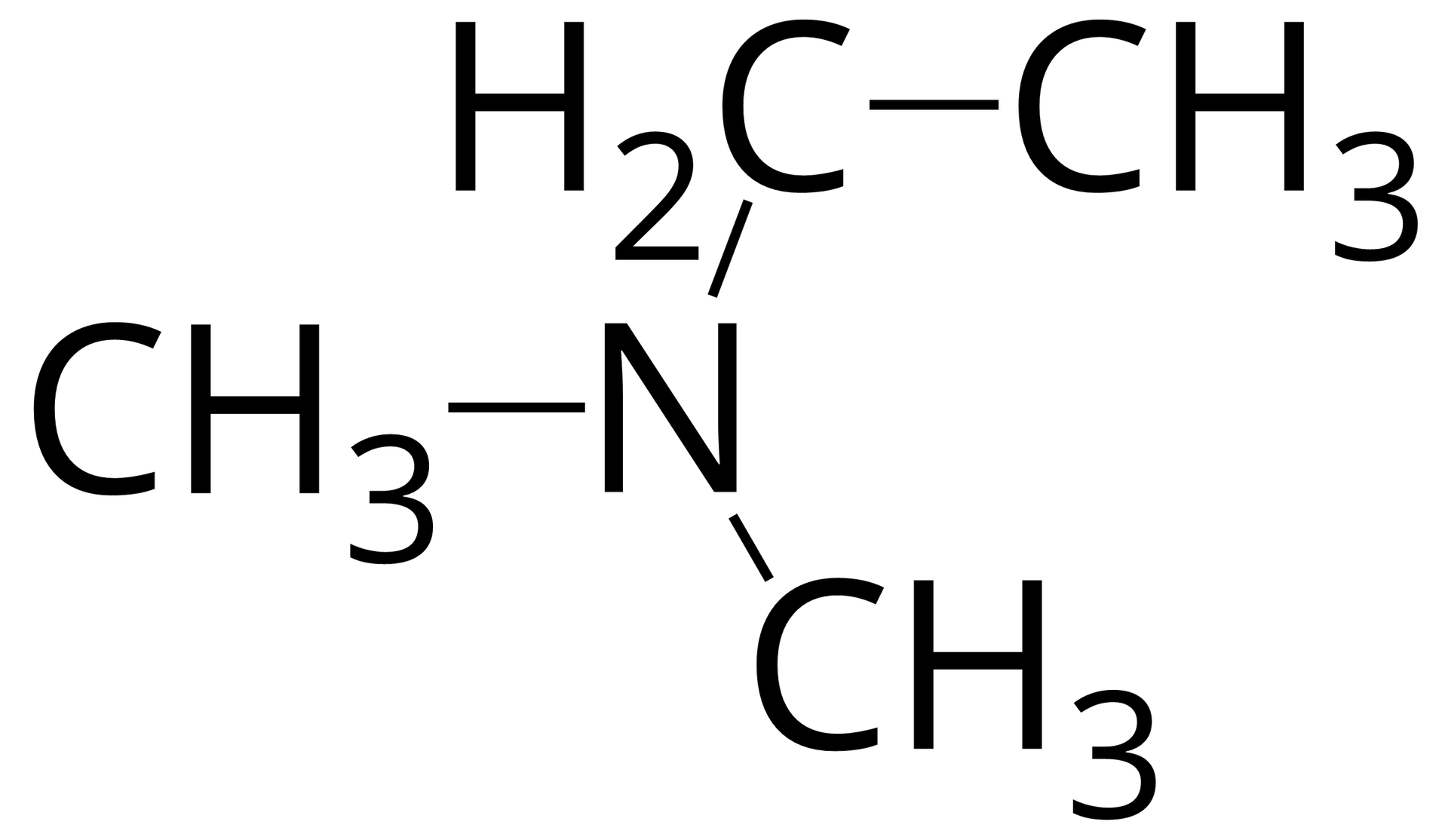 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. N,N- dimetyloetanoamina |
 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. benzenoamina | 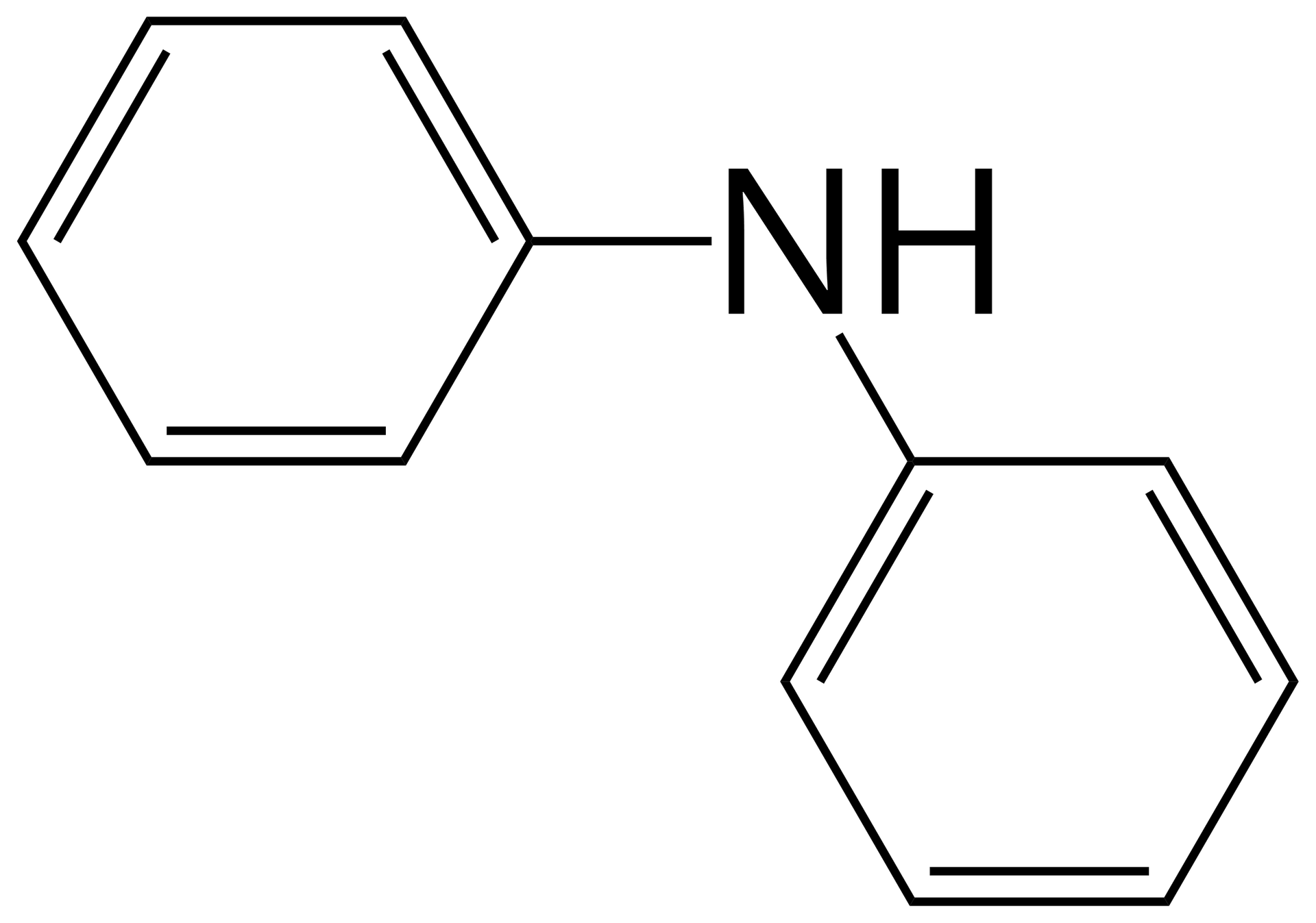 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. N‑fenyloanilina | 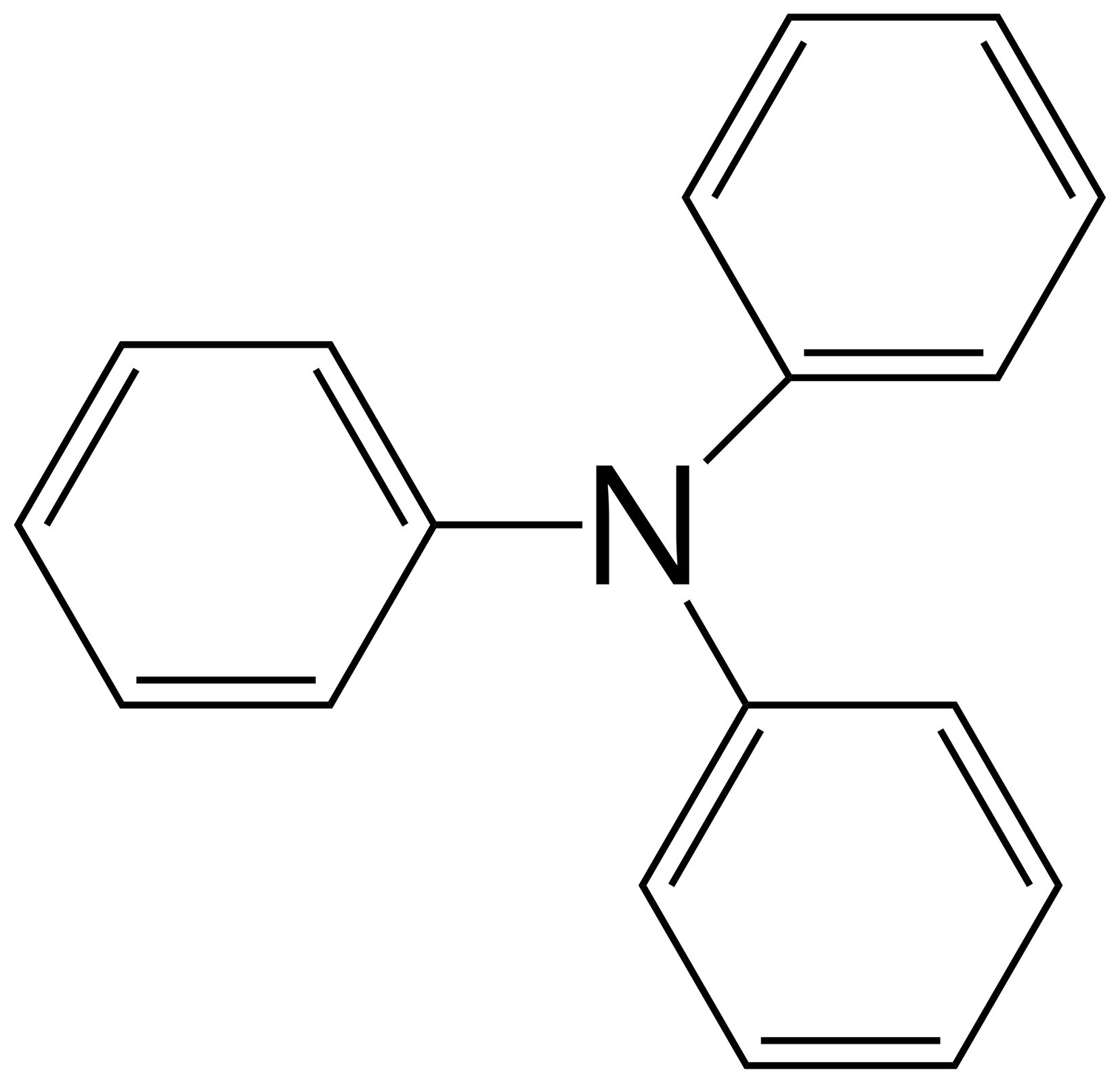 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. N,N‑difenyloanilina |
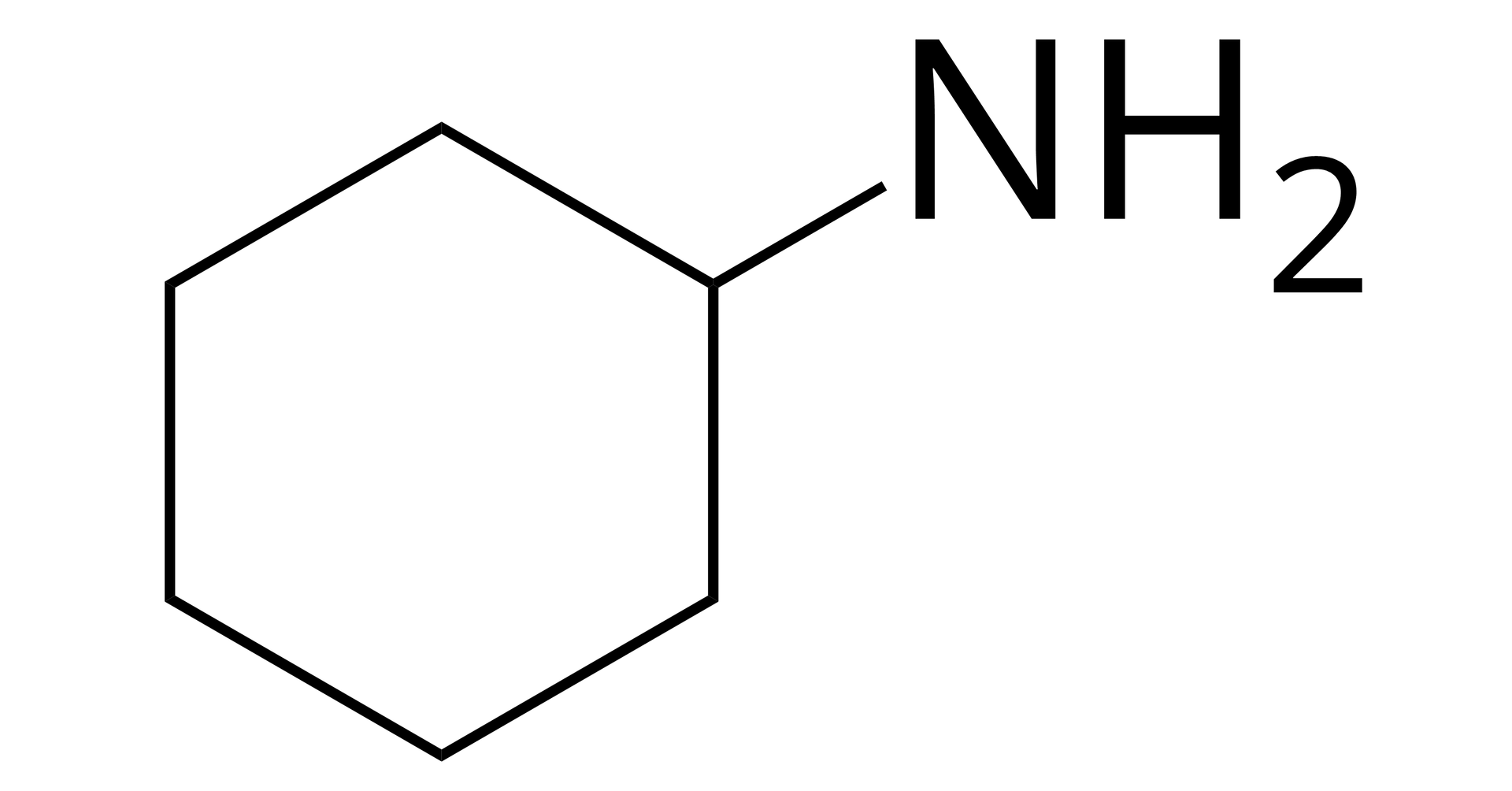 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. cykloheksanoamina |
Słownik
jednofunkcyjne związki organiczne będące pochodną amoniaku
to związki organiczne, w których atom azotu przyłączony jest bezpośrednio do łańcucha alifatycznego (węglowodorowego)
to związki organiczne, w których atom azotu przyłączony jest bezpośrednio do pierścienia aromatycznego
jednowartościowa grupa utworzona przez oderwanie jednego atomu wodoru od cząsteczki węglowodoru alifarycznego (najczęściej alkanu)
grupa utworzona przez oderwanie jednego atomu wodoru od pierścienia węglowodoru aromatycznego
Bibliografia
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa 1985.
McMurry J., Chemia organiczna, Warszawa 2000.
McMurry J., Chemia organiczna, Warszawa 2016.
Danikiewicz W., Część . Chemia organiczna, Warszawa 2009.
Kaznowski K., CHEMIA Vademecum maturalne, Warszawa 2016.