Przeczytaj
Aktywność enzymów
Więcej informacji na temat czynników wpływających na aktywność enzymów znajdziesz tutaj.
Aktywność enzymów zależy również od obecności niebiałkowych związków chemicznych – kofaktorówkofaktorów, które są niezbędne do specyficznego wiązania się enzymów z ich substratami. Więcej o działaniu kofaktorów przeczytasz w materiale: „Budowa, działanie i funkcje enzymów”.
Inhibicja
Aktywność enzymów może być hamowana przez niektóre związki chemiczne, tzw. inhibitory enzymów. Zalicza się do nich naturalnie występujące metabolitymetabolity komórkowe oraz substancje obcego pochodzenia, takie jak leki i toksyny. Związki te łączą się odwracalnie (inhibicja kompetycyjna i inhibicja niekompetycyjna) lub nieodwracalnie (inhibicja nieodwracalna) z enzymami, uniemożliwiając przyłączanie substratu.
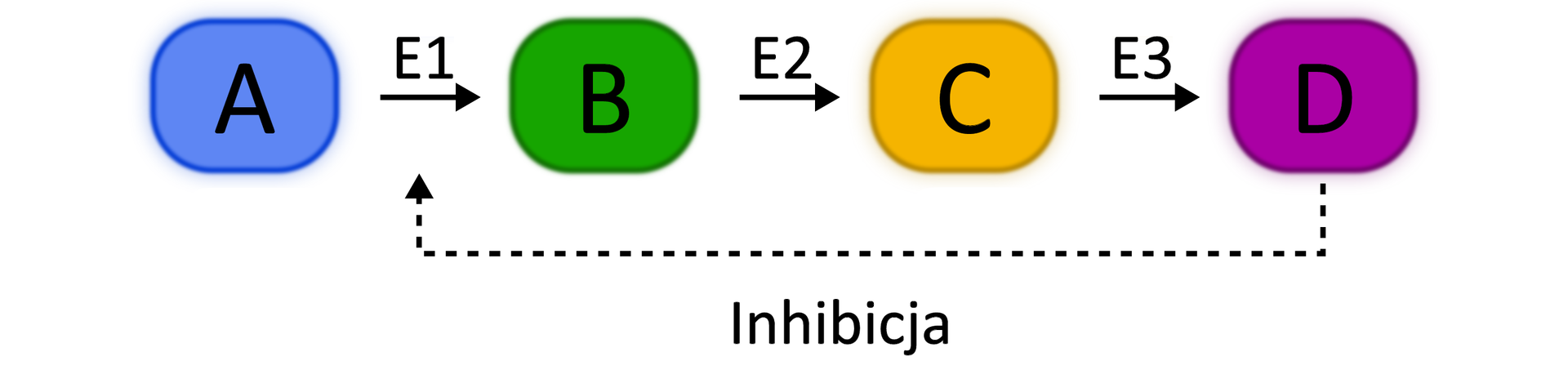
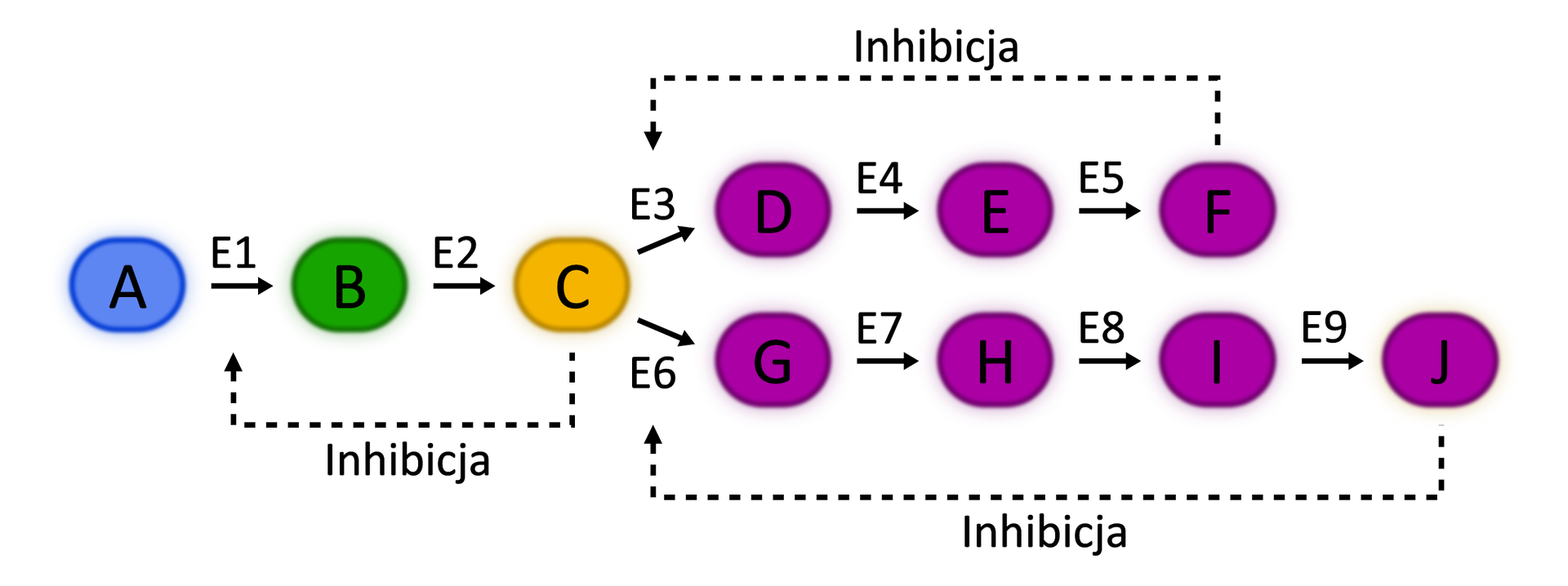
Sprzężenie zwrotne
Aktywatory enzymów
Aktywność enzymów może być także wzmacniana przez tzw. aktywatory. Należą do nich m.in. jony metali. Na przykład jony MgIndeks górny 2+2+ aktywują fosfatazy, FeIndeks górny 2+2+ – peroksydazy, MnIndeks górny 2+2+ – fosfotransferazy, a ZnIndeks górny 2+2+ – dehydrogenazę alkoholową. Niespecyficznymi aktywatorami enzymatycznymi są związki zapobiegające uszkodzeniom enzymów, np. przeciwutleniacze (glutationglutation, kwas askorbinowykwas askorbinowy, dysmutaza ponadtlenkowadysmutaza ponadtlenkowa) obecne w komórce w dużym stężeniu i neutralizujące aktywne formy tlenu.
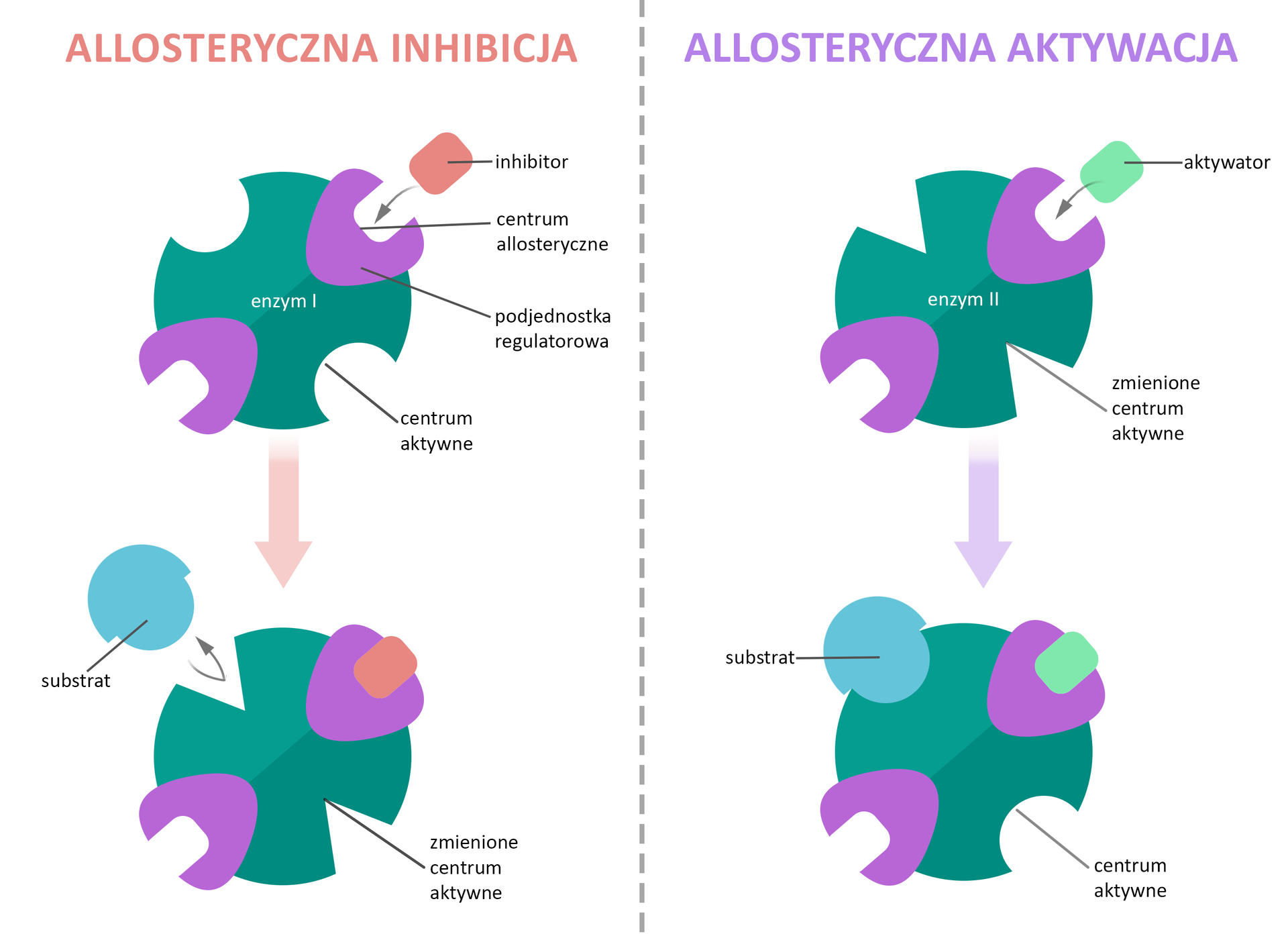
Enzymy allosteryczne
Nie zawsze efektor przyłączany jest do centrum aktywnego. Może on wiązać się w innym miejscu – centrum allosterycznymcentrum allosterycznym występującym w tzw. enzymach allosterycznych. Powoduje to zmianę konformacji białka, co z kolei prowadzi do modyfikacji centrum aktywnego. W konsekwencji następuje zmiana powinowactwa pozostałych miejsc do cząsteczek substratu. W przypadku enzymów allosterycznych cząsteczki sygnałowe regulujące ich pracę to regulatory (efektory allosteryczne). W zależności od typu przyłączonej cząsteczki może ona zmniejszać (inhibitor) lub zwiększać (aktywator) powinowactwo enzymu względem substratu, co będzie skutkowało hamowaniem lub przyspieszaniem jego aktywności.
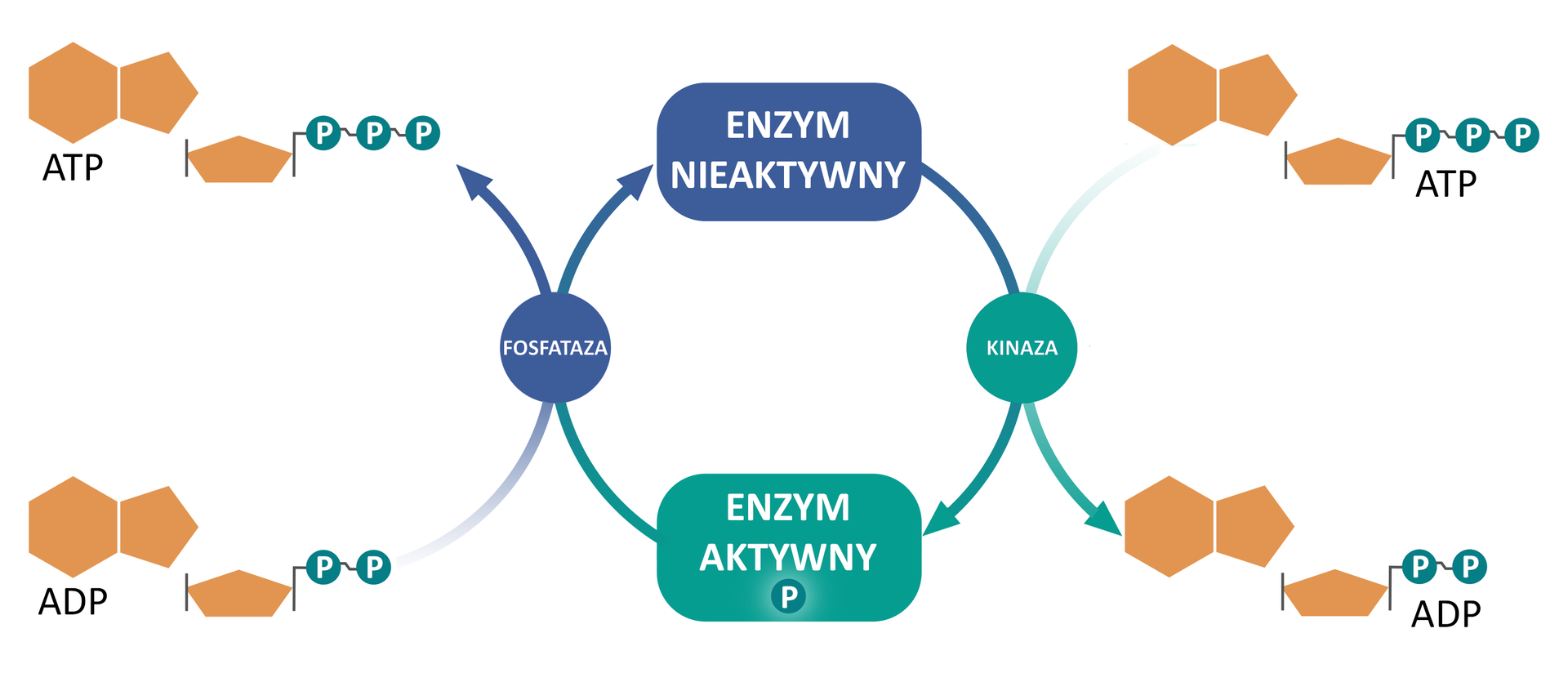
Odwracalne modyfikacje kowalencyjne
Zmiany struktury białka enzymatycznego i związane z tym zmiany jego aktywności mogą być spowodowane odwracalnymi modyfikacjami kowalencyjnymi. Polegają one na tworzeniu lub rozcinaniu wiązań między grupą białkową i niebiałkową enzymu. Do najczęstszych modyfikacji należą fosforylacjafosforylacja i defosforylacjadefosforylacja.
Aktywacja proteolityczna
Niektóre enzymy aktywowane są dzięki nieodwracalnej hydrolizie wiązań peptydowych, czyli tzw. aktywacji proteolitycznej. Zachodzi ona wtedy, gdy enzym produkowany jest w formie nieaktywnej (proenzym lub zymogen) i aktywowany dopiero w miejscu działania. Przykładem takiego enzymu jest trypsynatrypsyna, produkowana przez trzustkę jako proenzym – trypsynogen. Do aktywacji trypsyny dochodzi w jelicie cienkim pod wpływem działania innego enzymu – enteropeptydazy, która rozcina wiązania peptydowe.
Słownik
miejsce w apoenzymie, do którego przyłączają się efektory, czyli drobnocząsteczkowe związki wpływające na aktywność enzymu; enzymy, których aktywność jest regulowana w ten sposób, to enzymy allosteryczne
reakcja odłączania reszty fosforanowej
biokatalizator będący kluczowym ogniwem cyklu Krebsa, który bierze udział w podstawowych szlakach przemian węglowodanów, kwasów tłuszczowych oraz aminokwasów zarówno w kierunku katabolicznym, jak i anabolicznym
enzym z grupy oksydoreduktaz, katalizuje przekształcenie dwóch anionów OIndeks dolny 22Indeks górny –– do nadtlenku wodoru (HIndeks dolny 22OIndeks dolny 22 rozkładanego przez katalazę) i tlenu (OIndeks dolny 22); obecna we wszystkich organizmach tlenowych.
wielkość bariery energetycznej, która musi zostać przekroczona, aby doszło do reakcji chemicznej
reakcja przyłączania reszty fosforanowej
tripeptyd złożony z kwasu glutaminowego, cysteiny i glicyny; najważniejszy przeciwutleniacz w organizmie
substancja zwiększająca szybkość reakcji
niebiałkowe składniki niezbędne do katalitycznej aktywności wielu enzymów
potocznie aspiryna; pochodna kwasu salicylowego o działaniu przeciwbólowym, przeciwzapalnym, przeciwgorączkowym i przeciwagregacyjnym
witamina C (łac. acidum ascorbicum); organiczny związek chemiczny z grupy nienasyconych alkoholi polihydroksylowych, niezbędny do funkcjonowania organizmów żywych
produkty przemian chemicznych zachodzących w organizmach
antybiotyk, cząsteczka blokująca enzymy bakteryjne, które biorą udział w syntezie peptydoglikanu ściany komórkowej bakterii
oddziaływanie produktów końcowych procesu lub szlaku metabolicznego na cząsteczki wejściowe, np. enzymy
enzym biorący udział w syntezie peptydoglikanu ściany komórkowej bakterii
enzym proteolityczny, który trawi białka w jelicie cienkim; wytwarzany w trzustce jako proenzym – trypsynogen (forma nieczynna), a następnie transportowany do jelita cienkiego, gdzie przekształca się w trypsynę za sprawą enzymu śluzówki jelita cienkiego