Przeczytaj
Ogniwo Daniella
Ogniwo galwaniczne jest układem dwóch półogniw, połączonych ze sobą za pomocą klucza elektrolitycznego, dzięki któremu możliwy jest przepływ jonów, wyrównujący różnicę ładunków. Odpowiada on za przekazywanie elektronów. Źródłem prądu elektrycznego w ogniwie są reakcje redukcji i utlenienia.
Jednym z pierwszych ogniw było ogniwo Daniella, w którym na anodzieanodzie zachodzi utlenianieutlenianie cynku. Jony przechodzą do roztworu, natomiast elektrony wędrują do katodykatody, gdzie zachodzi redukcjaredukcja jonów . Przez klucz elektrolitycznyklucz elektrolityczny przemieszczają się jony przeciwnego znaku (), w celu wyrównania powstającej różnicy ładunków. Schemat ogniwa można zapisać następująco:
lub
Reakcje zachodzące na elektrodachelektrodach można zapisać równaniami:
Sumarycznie, procesy zachodzące w ogniwie, można przedstawić równaniem:
Co się dzieje podczas pracy ogniwa Daniella? Przeanalizujmy poniższy schemat.
Co się dzieje podczas pracy ogniwa Daniella? Zapoznaj się z opisem schematu.

Ilościowa interpretacja reakcji chemicznej zachodzącej w ogniwie
Warto zauważyć, że jeśli do roztworu przechodzi jonów cynku (1 molmol), to na miedzianej blaszce osadza się () jonów miedzi. Masa blaszki cynkowej maleje o , natomiast masa blaszki miedzianej wzrasta o . Blaszka cynkowa roztwarza się, natomiast na blaszce miedziowej miedź się osadza. Ogniwo pracuje do tego momentu (przepływa przez nie prąd), aż nie nastąpi całkowite roztworzenieroztworzenie płytki cynkowej, zanurzonej w roztworze (wszystkie atomy cynku obecne w płytce się utlenią), i redukcja wszystkich obecnych w roztworze kationów miedzi .
Ogniwa redoks i ogniwa stężeniowe
Inaczej wyglądają procesy elektrodowe, które zachodzą w ogniwach stężeniowych oraz ogniwach redoks.
Ogniwo stężeniowe zbudowane jest z dwóch jednakowych elektrod metalicznych, zanurzonych w roztworach z jonami potencjałotwórczymi tego metalu o różnych stężeniach: . Przykład ogniwa stężeniowego:

Różnica stężeń powoduje wyraźną różnicę potencjałów elektrod i dlatego anodą i katodą są odpowiednio:
Sumaryczna reakcja zachodząca w ogniwie:
Ogniwo pracuje do momentu wyrównania stężeń roztworów. SEM ogniwa można obliczyć następująco:
Ogniwo redoksowe (tzw. redoks) jest zbudowane z dwóch półogniw utleniająco‑redukujących, połączonych kluczem elektrolitycznym. Schemat takiego ogniwa przedstawia rysunek zamieszczony poniżej.
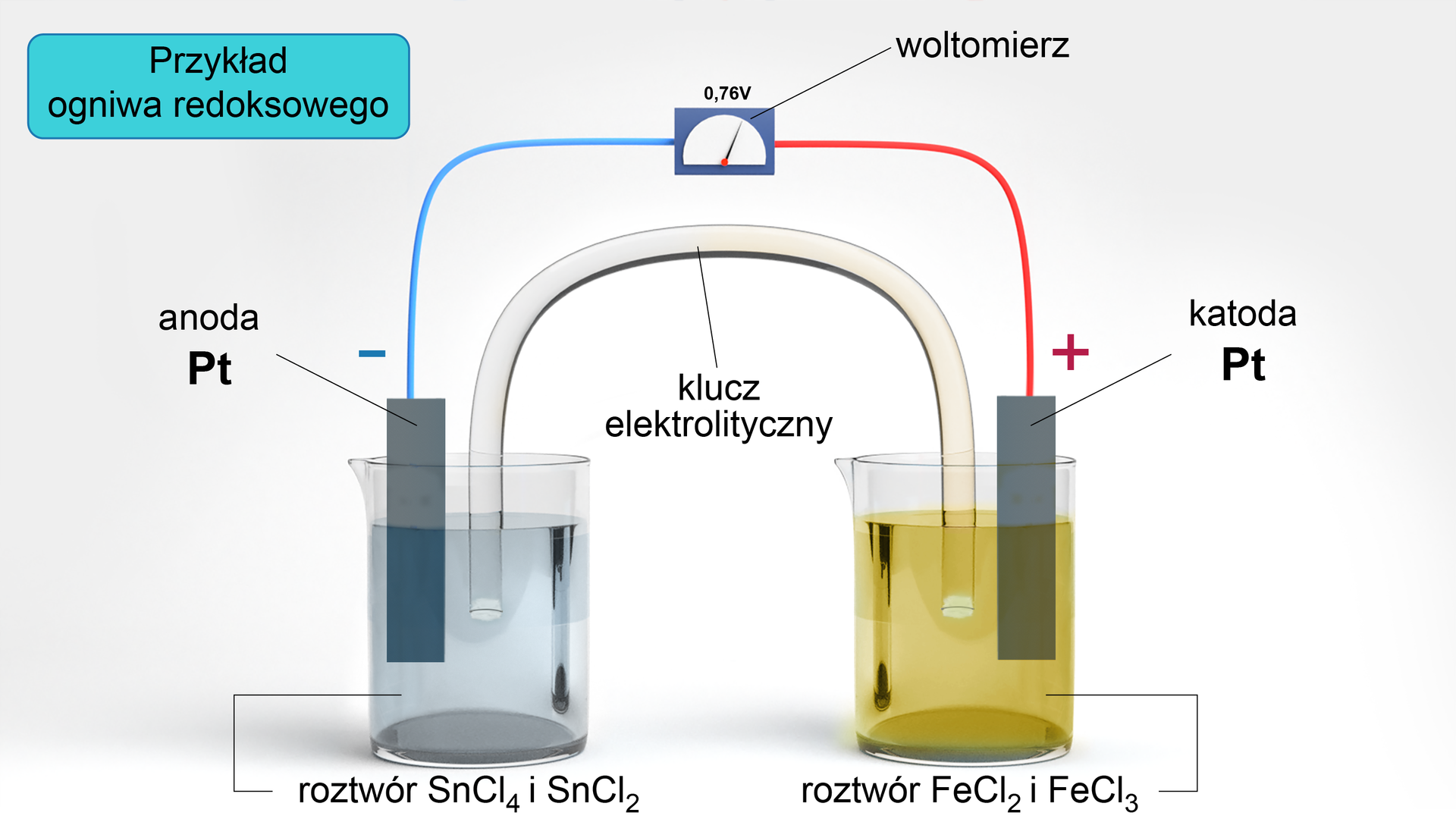
Schemat ogniwa redoksowego:
Sumaryczna reakcja zachodząca w ogniwie:
Siłę elektromotoryczną ogniwa (SEM) można obliczyć stosując potencjały standardowe półogniw, oznaczane jako . Wartość potencjału standardowego półogniwa jest różnicą pomiędzy potencjałem ogniwa wodorowego (dla którego przyjęto wartość ), a półogniwem badanego materiału – wielkości te są podane w tablicach fizykochemicznych. Przy obliczaniu SEM ogniwa, zawsze odejmujemy wartość potencjału anody od wartości potencjału katody.
Ogniwo Leclanchégo
Ogniwo Leclanchégo to ogniwo cynkowo‑węglowe, które stosowane jest w wielu bateriach dostępnych w sprzedaży. Jego istotną wadą jest brak możliwości regeneracji. Schemat budowy ogniwa cynkowo‑węglowego zapisuje się w następujący sposób:
Reakcje zachodzące na elektrodach można zapisać równaniami:

Wygodniejsze w użyciu są jednak ogniwa odwracalne, czyli takie, które po wyczerpaniu można ponownie naładować. Przykładem takiego jest akumulator kwasowo‑ołowiowy (akumulator Plantego), który jest często wykorzystywany jako źródło zasilania rozrusznika samochodowego.
Słownik
(gr. ánodos „droga w górę”) w ogniwie galwanicznym jest to elektroda posiadająca ładunek ujemny; zachodzi na niej reakcja utleniania
(gr. káthodos „schodzenie”) w ogniwie galwanicznym jest to elektroda posiadająca ładunek dodatni; zachodzi na niej reakcja redukcji
(gr. ḗlektron „bursztyn”, hodós „droga”) chemiczny układ złożony z przewodnika elektronowego (metal, półprzewodnik) stykającego się z przewodnikiem jonowym (najczęściej ciekły elektrolit), w którym może przebiegać reakcja elektrodowa utleniania‑redukcji
podstawowa jednostka liczności (ilości) materii w układzie SI, równa
oksydacja; chemiczny proces, który polega na oddaniu elektronu (elektronów) przez jon, atom lub grupę atomów, w wyniku czego podwyższa się stopień utlenienia pierwiastka oddającego elektrony
charakterystyczna dla każdej elektrody różnica potencjałów Galvaniego (potencjał elektryczny fazy) między fazami tworzącymi tę elektrodę (np. elektrolitem i metalem); powstaje jako konsekwencja uformowania się elektrycznej warstwy podwójnej
elektronizacja; chemiczny proces, który polega na pobraniu elektronu (elektronów) przez jon lub atom, w wyniku czego maleje stopień utlenienia pierwiastka
reakcja chemiczna prowadząca do otrzymywania jednorodnej mieszaniny wieloskładnikowej wskutek zachodzących oddziaływań między czynnikiem roztwarzającym a stałą substancją roztwarzaną
klucz; mostek solny; urządzenie łączące elektrolity w naczyniu elektrolitycznym, którego głównym zadaniem jest zmniejszenie potencjału dyfuzyjnego między tymi elektrolitami i zapobieganie ich mieszaniu się
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.