Przeczytaj
Otrzymywanie tlenków pierwiastków na wyższym stopniu utlenienia
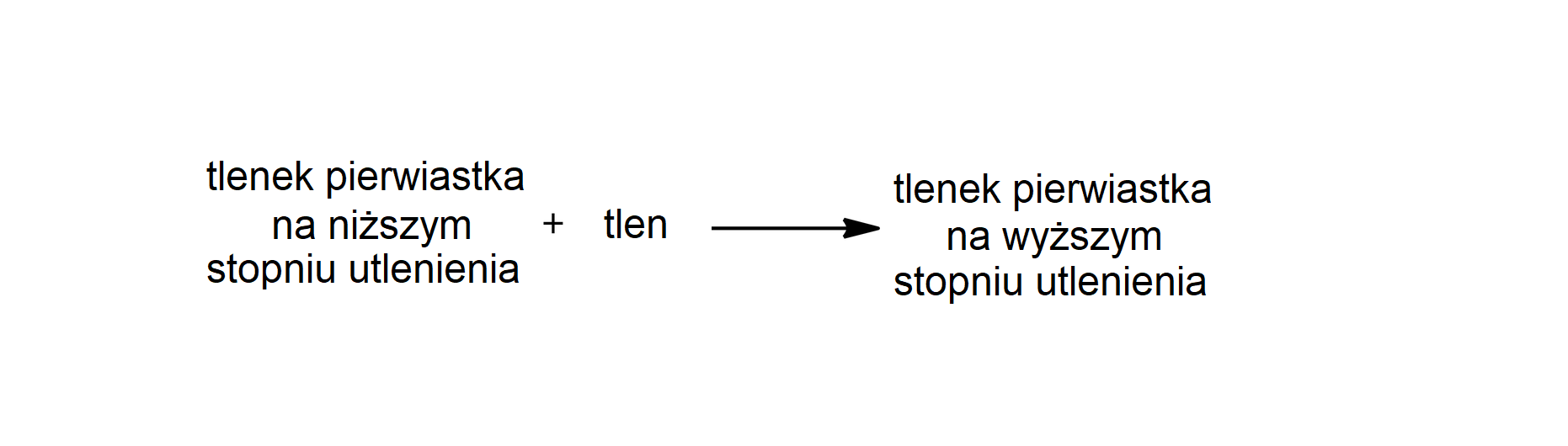
Niektóre pierwiastki w tlenkach występują na różnych stopniach utlenienia, np. węgiel tworzy tlenek węgla() oraz tlenek węgla(). Jedną z metod otrzymywania tlenków, w których atomy danego pierwiastka występują na wyższych stopniach utlenienia, jest utlenianie tlenków, w których atomy tego samego pierwiastka występują na niższych stopniach utlenienia. Potocznie mówimy o takiej metodzie jako o utlenieniu tlenków niższych do tlenków wyższych, mając w istocie na myśli wartości stopni utlenienia atomów pierwiastków tworzących wiązanie z tlenem.
Tlenki węgla | Tlenki siarki | Tlenki azotu |
|---|---|---|
Reakcje tlenków z tlenem zachodzą w różnych warunkach, w zależności od rodzaju i charakterystyki pierwiastka tworzącego dany tlenek.
Poniżej przedstawiono wybrane, najbardziej powszechne tlenki, które otrzymuje się opisaną metodą.
Tlenek siarki()

Tlenku siarki() nie można otrzymać w wyniku bezpośredniej syntezy pierwiastka z tlenem, czyli przez spalenie siarki w powietrzu. Wynika to z przesunięcia stanu równowagi reakcji w stronę substratów, ze względu na wydzielające się duże ilości ciepła. Wzrost temperatury dla reakcji egzotermicznych powoduje spadek wydajności reakcji. Dlatego, aby otrzymać tlenek siarki(), należy przeprowadzić reakcję utleniania tlenku siarki(), zgodnie z poniższym równaniem reakcji:
Reakcja ta jest egzotermiczna i zachodzi z dobrą wydajnością, w temperaturach od około do , co powoduje spadek szybkości reakcji. Dlatego, aby przyspieszyć tę reakcję, niezbędne jest zastosowanie katalizatorakatalizatora, którym współcześnie jest tlenek wanadu() .
Tlenek węgla()
Otrzymywanie tlenku węgla() opisaną metodą zachodzi podczas utleniania tlenku węgla(), zgodnie z poniższym równaniem reakcji:

Reakcja zachodzi w temperaturze pokojowej tylko w obecności katalizatorów – mieszaniny tlenku miedzi(), tlenku kobaltu(), tlenku manganu() oraz tlenku srebra(), o nazwie handlowej Hopkalit. Tlenek węgla() spala się niebieskim płomieniem, a podczas reakcji uwalnia się bardzo dużo ciepła. Jest to reakcja egzotermiczna.
Hopkalit to porowata mieszanina substancji, przypominająca wyglądem węgiel aktywny. Stosowany jest w produkcji masek przeciwgazowych i służy do utlenienia silnie trującego, bezbarwnego i bezwonnego gazu tlenku węgla() (tzw. czadu) do nietoksycznego tlenku węgla() . Ponadto oczyszcza powietrze z innych zanieczyszczeń. Maski te stosowane są bardzo często przez strażaków oraz górników.
Wspomniana reakcja zachodzi również bez użycia katalizatora, ale wówczas wymaga wysokiej temperatury – około .
Tlenek azotu()
Tlenek azotu() otrzymywany jest przez utlenianie tlenku azotu(), zgodnie z poniższym równaniem reakcji:

Reakcja jest egzotermiczna i zachodzi na powietrzu bez specjalnych, dodatkowych warunków. Bezbarwny gaz, tlenek azotu() , w zetknięciu z tlenem atmosferycznym, przechodzi bardzo szybko w brunatny gaz – tlenek azotu() . Reakcja ta stanowi jeden z procesów pośrednich w przemysłowej produkcji kwasu azotowego().
Tlenek żelaza()
Tlenek żelaza powstaje często w wyniku utleniania tlenku żelaza tlenem atmosferycznym, zgodnie z poniższym równaniem reakcji:
Jednak nie jest to reakcja, którą stosuje się powszechnie, aby otrzymać tlenek żelaza. Utlenianie zachodzi często w sposób niezamierzony, np. podczas wieloletniego przechowywania tlenku żelaza w laboratorium.
Słownik
związki chemiczne tlenu z innymi pierwiastkami, w których atom tlenu występuje na stopniu utlenienia
atom, cząsteczka lub jon, który w reakcjach redoks przyjmuje elektrony (jest akceptorem elektronów)
atom, cząsteczka lub jon, który w reakcjach redoks oddaje elektrony (jest donorem elektronów)
zachodzące łącznie procesy utlenienia i redukcji; utlenianie – oddawanie elektronów przez atom, cząsteczkę lub jon; redukcja – przyjmowanie elektronów przez atom, cząsteczkę lub jon
substancja chemiczna, którą dodaje się do układu w celu zwiększenia szybkości reakcji chemicznej; katalizator bierze udział w reakcji, ale po jej zakończeniu pozostaje w ilości niezmienionej
Bibliografia
Bielański A., Podstawy chemii nieorganicznej 2, Warszawa 2013.
Pazdro K. M., Chemia. Podręcznik do kształcenia rozszerzonego w liceach, Część IV. Chemia nieorganiczna, Warszawa 2009.

